کلرات
آنیون کلرات، به ساختار شیمیایی ClO۳− گفته میشود همچنین به ترکیباتی که در آنها این یون وجود داشته باشد نیز کلرات گفته میشود. عدد اکسایش کلر ۵+ است. کلراتها نمکهای اسید کلریکاند. هنگامی که از یک عدد رومی در کنار نام کلرات استفاده شود برای اشاره به گونهای، اکسی آنیون کلر بودهاست.
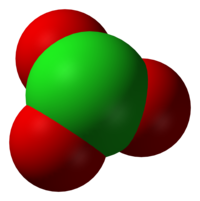
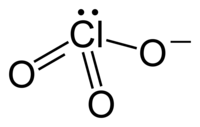
بر پایهٔ نظریهٔ دافعهٔ زوج الکترون لایهٔ ظرفیتی، آنیون کلرات باید ساختار هرمی سه بعدی داشته باشد. کلراتها، اکسیدکنندههای قوی اند و باید آنها را از مواد آلی یا موادی که به آسانی دچار اکسایش میشوند دور نگه داشت.
ساختار هندسی و پیوند ویرایش
یون کلرات را نمیتوان با یک ساختار لوویس نمایش داد چون همهٔ پیوندهای Cl-O دارای یک طول اند (۱٫۴۹ آنگستروم در پتاسیم کلرات[۱]) و اتم کلر اتمی با تعداد بالای الکترون لایه ظرفیت است.
فراهم آوری ویرایش
در آزمایشگاه ویرایش
کلرات فلزها را میتوان با افزودن کلر به هیدروکسید داغ فلز مانند هیدروکسید پتاسیم بدست آورد:
- ۳ Cl۲ + ۶ KOH → ۵ KCl + KClO۳ + ۳ H۲O
در اینجا واکنش تسهیم نامتناسب داریم که در آن کلر با عدد اکسایش صفر، کلرید با عدد اکسایش ۱- و کلرات با عدد اکسایش ۵+ را پدید میآورد. از واکنش هیدروکسید سرد آبدار فلز، کلرید و هیپوکلریت بدست میآید.
در صنعت ویرایش
تولید صنعتی کلرات سدیم به جای گاز کلر، از محلول کلرید سدیم آبدار آغاز میشود. اگر ابزارهای الکترولیز امکان ترکیب کلر و سدیم هیدروکسید را بدهد آنگاه واکنش تسهیم نامتناسب توضیح داده شده در بالا روی میدهد. گرمادهی ۵۰ تا ۷۰ درجهای به واکنش دهندهها بوسیلهٔ توان الکتریکی بکار رفته در برق کافت صورت میگیرد.[نیازمند منبع]
در طبیعت ویرایش
پژوهشها نشان داده است که رسوبهای کلرات در مناطق خشک زمین با غلظت بالا پیدا میشود.[۲] همچنین در نمونههای باران هم یون کلرات دیده شدهاست که مقدار آن با پرکلرات برابر بودهاست؛ به همین دلیل گمان آن میرود که کلرات و پرکلرات باید سرچشمهٔ پیدایش مشابهی در طبیعت داشته باشند و این میتواند بخشی از چرخهٔ کلر در شیمی زمین باشد. اندامکهایی وجود دارند که میتوانند کلرات را دچار کاهش به کلرید کنند.[۳]
نمکها ویرایش
- همچنین ببینید رده:کلراتها
موارد زیر از جمله کلراتها است:
- پتاسیم کلرات KClO۳
- سدیم کلرات NaClO۳
- منیزیم کلرات Mg(ClO۳)۲
دیگر اکسی آنیونها ویرایش
اگر یک عدد رومی در پرانتز کنار نام کلرات باشد به این معنی است که اکسی آنیون دارای کلر با عدد اکسایش گفته شده دارد. برای نمونه:
در اینجا نام «کلرات» به معنی هر اکسی آنیون کلر است اما معمولاً عبارت «کلرات» برای اشاره به کلرهای با عدد اکسایش ۵+ است.
منبع ویرایش
- ↑ J. Danielsen, A. Hazell, F. K. Larsen (1981). "The structure of potassium chlorate at 77 and 298 K". Acta Cryst. B37: 913–915. doi:10.1107/S0567740881004573.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Rao, B. ; Hatzinger, P. B. ;Böhlke, J. K. ; Sturchio, N. C. ; Andraski, B. ; Frank D. Eckardt. ; Jackson, W. A.Natural Chlorate in the Environment: Application of a New IC-ESI/MS/MS Methodwith a Cl18O3- Internal Standard. Environ.Sci. Technol. 2010, 44,8429-8434.
- ↑ Coates,J.D. ;Achenbach,L.A.Microbialperchloratereduction:rocketfuelledmetabolism. Nature Rev. Micobol. 2004, 2, 569–580.