سیناپس تحریکی
سیناپس تحریکی (excitatory synapse)، سیناپسی است که در آن پتانسیل کنش در نورون پیش-سیناپسی - یعنی نورون قبل، که همان نورون تحریک کننده مورد نظر ماست - احتمال وقوع پتانسیل کنش در سلول پس-سیناپسی - یعنی سلول تحریک شونده بعدی اعم از عصبی یا غیر عصبی (مانند غده یا ماهیچه)- را افزایش میدهد. این نورونها شبکههایی را تشکیل میدهند که از طریق آن تکانههای عصبی حرکت میکنند و هر نورون اغلب ارتباطات متعددی با سلولهای دیگر برقرار میکند. این سیگنالهای الکتریکی ممکن است تحریک کننده یا بازدارنده باشند، و اگر تأثیرات تحریکی از تأثیرات بازدارنده بیشتر شود، نورون پتانسیل عمل جدیدی در تپه آکسون خود ایجاد میکند، بنابراین اطلاعات را به سلول دیگری منتقل میکند.[۱]
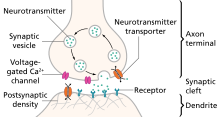
این پدیده به عنوان یک پتانسیل پس سیناپسی تحریکی (EPSP) شناخته میشود؛ که ممکن است از طریق تماس مستقیم بین سلولها (یعنی از طریق اتصالات شکافدار)- مانند سیناپس الکتریکی - رخ دهد؛ اما معمولاً از طریق انتشار میانجیهای عصبی (تحت وزیکول) از پایانه آکسون پیشسیناپسی به شکاف سیناپسی - مانند یک سیناپس شیمیایی - رخ میدهد.[۲]
میانجیهای عصبی تحریککننده، که رایجترین آنها گلوتامات است، از طریق انتشار به ستون فقرات دندریتیک نورون پس-سیناپسی میروند و پروتئین گیرنده سطح سلول خاصی را به آن متصل میکنند که باعث دپلاریزاسیون آن سلول میشود.[۱] دپلاریزاسیون احتمال پتانسیل عمل را افزایش میدهد که معمولاً با هجوم یونهای سدیم با بار مثبت (Na +)، به داخل سلول پس-سیناپسی، از طریق کانالهای یونی که با اتصال میانجی عصبی فعال شدهاند، رخ میدهد.
سیناپسهای شیمیایی در مقابل الکتریکی
ویرایش- دو نوع مختلف سیناپس در مغز انسان وجود دارد: شیمیایی و الکتریکی. سیناپسهای شیمیایی تا حد زیادی شایعترین هستند و دارای نقش اصلی در سیناپسهای تحریک کننده هستند. اما سیناپسهای الکتریکی، اقلیت هستند. این سیناپسها اجازه جریان مستقیم و غیرفعال جریان الکتریکی را از طریق اتصالات بین سلولی ویژه ای به نام اتصالات شکاف میدهند.[۳] این اتصالات شکاف، امکان انتقال تقریباً آنی سیگنالهای الکتریکی را از طریق جریان انفعالی مستقیم یونها بین نورونها فراهم میکنند (انتقال میتواند دو طرفه هم باشد). هدف اصلی سیناپسهای الکتریکی همگام سازی فعالیت الکتریکی در میان جمعیتهای نورونها است.[۳] اولین سیناپس الکتریکی در سیستم عصبی خرچنگ کشف شد.[۳]
- انتقالِ سیناپسی-شیمیایی ، انتقال میانجیهای عصبی یا نوروپپتیدها از آکسون پیش-سیناپسی به دندریت پس-سیناپسی است. برخلاف سیناپسهای الکتریکی، سیناپسهای شیمیایی با فضایی به نام شکاف سیناپسی از هم جدا میشوند که معمولاً بین ۱۵ تا ۲۵ نانومتر اندازهگیری میشود.انتقال یک سیگنال تحریکی شامل چندین مرحله است که در زیر به آنها اشاره شدهاست:
انتقال سیناپسی
ویرایش- در نورونهایی که در انتقال سیناپسی شیمیایی نقش دارند، میانجیهای عصبی - بسته به نوع میانجی عصبی سنتز شده و محل آنزیمهای دخیل در سنتز آن- یا در بدنه سلول عصبی یا در پایانه پیشسیناپسی سنتز میشوند. این میانجیهای عصبی در وزیکولهای سیناپسی ذخیره میشوند که توسط پروتئینهای تحت تأثیر کلسیم در نزدیکی غشاء بسته میشوند.
- به منظور راه اندازی فرایند انتقال سیناپسی شیمیایی، فعالیت بالادستی باعث میشود که یک پتانسیل عمل به پایانه پیش سیناپسی سرازیر شود.
- این جریان دیپلاریز کننده (قطب زداینده)، به پایانه پیش-سیناپسی میرسد و دیپلاریزاسیون غشایی که در آنجا ایجاد میکند باعث باز شدن کانالهای وابسته به ولتاژ کلسیمی در غشای پیش سیناپسی میشود.
- غلظت بالایی از کلسیم در شکاف سیناپسی بین دو نورون شرکت کننده (پیش سیناپسی و پس سیناپسی) وجود دارد. این تفاوت در غلظت کلسیم بین شکاف سیناپسی و داخل پایانه پیش-سیناپسی، یک اختلاف غلظت قوی ایجاد میکند که با باز کردن این کانالهای وابسته به ولتاژ کلسیمی، کلسیم را به سمت پایانه پیش-سیناپسی هدایت میکند. این هجوم کلسیم به انتهای پیش-سیناپسی برای آزادسازی میانجی عصبی ضروری است.
- پس از ورود به پایانه پیش-سیناپسی، کلسیم به پروتئینی به نام سیناپتوتاگمین متصل میشود که روی غشای وزیکولهای سیناپسی قرار دارد. این پروتئین با پروتئینهای دیگری به نام SNARE به منظور القای همجوشی وزیکول با غشای پیش سیناپسی تعامل دارد. در نتیجه این همجوشی وزیکول، میانجیهای عصبی که در وزیکول سیناپسی بستهبندی شده بودند به سیناپس رها میشوند، جایی که در شکاف سیناپسی پخش میشوند.
- این میانجیهای عصبی به گیرندههای مختلفی روی غشای سلولی پس سیناپسی متصل میشوند. در پاسخ به اتصال میانجیهای عصبی، این گیرندههای پس سیناپسی میتوانند تحت تغییرات ساختاری قرار گیرند که ممکن است یک زیربخش کانال گذرنده را - بهطور مستقیم یا غیرمستقیم - از طریق یک مسیر سیگنال دهی G-پروتئین باز کند. نفوذپذیری انتخابی این کانالها به یونهای خاصی اجازه میدهد تا در امتداد شیب (اختلاف پتانسیل)های الکتروشیمیایی خود حرکت کنند و جریانی را در سراسر غشای پس سیناپسی القا کنند که یک پاسخ تحریکی یا مهاری را تعیین میکند.
انواع میانجیهای عصبی تحریکی
ویرایشاستیل کولین
ویرایشگلوتامات
ویرایشکاتکول آمینها
ویرایشسروتونین
ویرایشهیستامین
ویرایشبیماری
ویرایش- سیناپسهای تحریکی نقش اساسی در پردازش اطلاعات در مغز و در سراسر سیستم عصبی محیطی دارند.
- مورفولوژی فیزیکی سیناپسها برای درک عملکرد آنها بسیار مهم است. از دست دادن شدید پایداری سیناپسی منجر به اختلال در مدارهای عصبی و بیماریهای عصبی ناشی از آن میشود. اگرچه علل مختلف بیشماری برای بیماریهای نورودژنراتیو مختلف، مانند تمایلات ژنتیکی یا جهشها، روند طبیعی پیری، علل انگلی و ویروسی یا مصرف دارو وجود دارد، بسیاری از آنها را میتوان به سیگنالهای ناکارآمد بین خود نورونها، اغلب در سیناپس، ردیابی کرد.
سمیت تحریکی
ویرایشپاتوفیزیولوژی
ویرایش- از آنجایی که گلوتامات رایجترین میانجی عصبی تحریکی است که در انتقال عصبی سیناپسی دخیل است، نتیجه میشود که اختلال در عملکرد طبیعی این مسیرها میتواند اثرات مخرب شدیدی بر سیستم عصبی داشته باشد. منبع اصلی استرس سلولی مربوط به تحریک بیش از حد گلوتامینرژیک یک نورون پس سیناپسی از طریق فعال شدن بیش از حد گیرندههای گلوتامات (یعنی گیرندههای NMDA و AMPA) است، فرآیندی که به عنوان سمیت تحریکی شناخته میشود، که اولین بار بهطور تصادفی توسط دکتر لوکاس و جی پی نیوهاوس در سال ۱۹۵۷، در طی آزمایش بر روی موشهای آزمایشگاهی تغذیه شده با سدیم کشف شد.
رفتار
ویرایش- مکانیسمهای اکسیتوتوکسیک اغلب، در شرایط دیگری که منجر به آسیب عصبی میشود دخیل هستند، از جمله هیپوگلیسمی، ضربه، سکته، تشنج و بسیاری از بیماریهای عصبی؛ بنابراین این مکانیسمها پیامدهای مهمی در درمان بیماری دارند. مطالعات اخیر از آنتاگونیستهای گیرنده گلوتامات و مختل کنندههای آبشار اکسیتوتوکسیک به منظور کاهش تحریک نورونهای پس-سیناپسی استفاده میکنند، اگرچه این درمانها هنوز در حال انجام تحقیقات فعال هستند.[۴]
بیماریهای عصبی مرتبط
ویرایشجستارهای وابسته
ویرایش- سیناپس مهاری
- انتقال عصبی
- علوم اعصاب
- سیناپتوژنز
- الکتروفیزیولوژی
- سمیت عصبی
- ↑ ۱٫۰ ۱٫۱ M. Sheng; C. Hoogenraad (2006). "The Postsynaptic Architecture of Excitatory Synapses: A More Quantitative View". Annual Review of Biochemistry. 76: 823–47. doi:10.1146/annurev.biochem.76.060805.160029. PMID 17243894. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «Annual Review of Biochemistry» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Chua, Kindler; Boykin, Jahn (2010-03-03). "Architecture of an Excitatory Synapse". Journal of Cell Science. 123 (6): 819–823. doi:10.1242/jcs.052696. PMID 20200227.
{{cite journal}}:|hdl-access=requires|hdl=(help) - ↑ ۳٫۰ ۳٫۱ ۳٫۲ D. Purves و همکاران (2008). Neuroscience, 4th ed. ساندرلند، ماساچوست: Sinauer Associates, Inc.
- ↑ M. Aarts; M. Tymianski (2003-09-15). "Novel treatment of excitotoxicity: targeted disruption of intracellular signalling from glutamate receptors". Biochemical Pharmacology. 66 (6): 877–886. doi:10.1016/S0006-2952(03)00297-1. PMID 12963474.