تصویربرداری عصبی
این مقاله نیازمند بررسی توسط یک متخصص است. لطفاً پارامتر دلیل یا بحث در این الگو را برای مشخصکردن مشکل مقاله استفاده کنید. |
این مقاله ممکن است نیازمند تمیزکاری باشد تا با استانداردهای کیفی ویکیپدیا همخوانی پیدا کند. مشکل ویژهٔ این مقاله: ویکی-متن غیر-استاندارد. |
تصویربرداری عصبی یا تصویربرداری مغز استفاده از تکنیکهای مختلف به منظور عکسبرداری بهطور مستقیم یا غیرمستقیم از ساختار، عملکرد یا فارماکولوژی دستگاه عصبی است. این رشته، رشتهای نسبتاً جدید بین رشتههای پزشکی، علوم اعصاب و روانشناسی است.[۱]
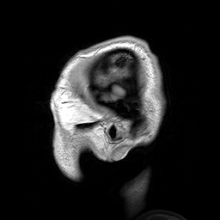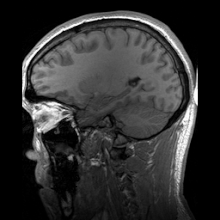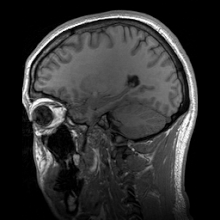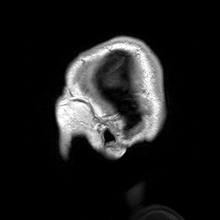
پرتوشناسی عصبی (Neuroradiology) با تصویربرداری عصبی (Neuroimaging) متفاوت است. تصویربرداری عصبی به دو دستهٔ گسترده تقسیم میشود:
- تصویربرداری ساختاری، که به ساختار دستگاه عصبی و تشخیص بیماریهای حاد (در مقیاس بزرگ) درون جمجمهای (مانند تومور) و آسیبها میپردازد.
- تصویربرداری عصبی کارکردی که به تشخیص بیماریها و ضایعات متابولیکی در مقیاس کوچکتر (مانند بیماری آلزایمر) و نیز تحقیقات روانشناسی شناختی و عصبی و ساخت رابطهای مغز و رایانه میپردازد.
برای مثال، تصویربرداری کارکردی، امکان پردازش اطلاعات توسط کانونهایی از مغز به منظور تجسم مستقیم را فراهم میسازد. چنین پردازشی باعث افزایش سوخت و ساز منطقهٔ درگیر در مغز و متمایز شدن آنها حین اسکن میشود. یکی از کاربردهای بحثبرانگیزتر تصویربرداری عصبی، مطالعه پیرامون "شناسایی فکر" یا ذهنخوانی است.
تاریخچه
ویرایشنخستین فصل تاریخچهٔ تصویربرداری عصبی به آنجلو موسو، عصبشناس ایتالیایی برمیگردد که با طرح ایدهٔ "تعادل گردشی انسانی" میتواند به صورتی غیرتهاجمی به سنجش توزیع مجدد خون طی فعالیتهای عاطفی و فکری بپردازد.[۲] با این حال، با وجود اینکه تنها بهطور خلاصه توسط ویلیام جیمز در سال ۱۸۹۰ ذکر شد، اما جزئیات و نکات ریز این تعادل و آزمایشهای موسو، نوشتهٔ استفانو ساندرونه و همکارانش تا حد زیادی ناشناخته باقی ماند.[۳]
در سال ۱۹۱۸ والتر دندی، جراح مغز و اعصاب آمریکایی، تکنیک بطنی را معرفی کرد. تصاویر پرتو ایکس دستگاه بطنی درون مغز از طریق تزریق مستقیم هوای فیلتر شده به یک یا هر دو بطن جانبی مغز بهدست میآید. دندی همچنین مشاهده کرد که هوای وارد شده به فضای زیرعنکبوتیه از طریق شکاف فقراتی کمری میتواند وارد بطن مغزی شده و همچنین فضاهای سیال مغزی-نخاعی در اطراف مرکز مغز و سطح آن را نشان داد. این روش پنوموآنسفالوگرافی نامیده میشد.
در سال ۱۹۲۷، آنتونیو اگاس مونیس به معرفی آنژیوگرافی مغزی پرداخت، که طی آن هر دو عروق خونی طبیعی و غیرطبیعی مغز و اطراف آن را با دقت بسیار بالا دید.
در اوایل دههٔ ۱۹۷۰ آلن کورماک و گادفری هانسفیلد به ارائهٔ توموگرافی محوری کامپیوتری شده (CAT یا CT scanning) پرداخته و تصاویر آناتومیک مغزی دقیقتری با اهداف تشخیصی و تحقیقاتی در دسترس قرار گرفت. کورمک و هونسفیلد جایزهٔ نوبل فیزیولوژی یا پزشکی را برای کار خود بهدست آوردند. بلافاصله پس از معرفی CAT در اوایل دههٔ ۱۹۸۰، توسعهٔ پرتولیگاندها امکان انجام مقطعنگاری رایانهای تکفوتونی (SPECT) و برشنگاری با گسیل پوزیترون (PET) مغز را فراهم کرد.
همزمان، کمی زودتر یا بعدتر، تصویربرداری پرتو مغناطیسی (MRI یا اسکن MR) توسط محققان از جمله پیتر منسفیلد و پال لاتربور ابداع شد که جایزهٔ نوبل فیزیولوژی یا پزشکی را در سال ۲۰۰۳ را دریافت کردند. در اوایل دههٔ ۱۹۸۰ امآرآی به صورت بالینی معرفی شد و در دههٔ ۱۹۸۰ یک انفجار حقیقی از برنامههای تدوین فنی و برنامههای تشخیصی امآرآی صورت گرفت. دانشمندان بهزودی متوجه شدند که تغییرات وسیع جریان خون که قابل اندازهگیری با PET بودند میتوانستند توسط نوع صحیحی از امآرآی نیز تصویربرداری شوند. تصویربرداری رزونانس مغناطیسی کارکردی (fMRI) متولد شده و از دههٔ ۱۹۹۰، fMRI به دلیل آسیبهای کم آن، عدم تابش پرتو و دسترسی نسبتاً گسترده، در حوزهٔ تصویربرداری مغزی غالب شد.
در اوایل دههٔ ۲۰۰۰، موضوع تصویربرداری عصبی به مرحلهای رسید که در آن کاربرد عملی کاربردی تصویربرداری عصبی عملکردی امکانپذیر بود. زمینهٔ کاربردی اصلی، فرمهای خام واسط مغز و رایانه است.
علائم
ویرایشتصویربرداری عصبی به دنبال یک معاینهٔ عصبی ایجاب میگردد که طی آن، پزشک دلیلی برای مطالعهٔ دقیقتر فرد بیماری که اختلال عصبی داشته یا احتمال میرود داشته باشد، یافته است. یکی از شایعترین مشکلات عصبی که فرد ممکن است تجربه کند، سنکوپ ساده است.[۴] در موارد سنکوپ ساده که در آن، پیشینهٔ بیمار فاقد هر گونه علائم عصبی دیگری است، یک معاینهٔ عصبی برای تشخیص کفایت مینماید، اما تصویربرداری عصبی تجویز نمیشود، زیرا احتمال یافتن علتی در دستگاه عصبی مرکزی بسیار پایین بوده و بعید است این روش برای بیمار مفید باشد.[۵]
تصویربرداری عصبی، برای بیماران مبتلا به سردرد پایدار، که بهعنوان میگرن تشخیص داده میشوند، تجویز نمیگردد.[۶] مطالعات نشان میدهد که حضور میگرن خطر ابتلا به بیماری داخل جمجمه را افزایش نمیدهد.[۶] تشخیص میگرن که فقدان مشکلات دیگری مانند papilledema را نشان میدهد، نیازی به تصویر برداری عصبی ندارد. در حین انجام یک تشخیص دقیق، پزشک باید در نظر بگیرد که آیا سردرد مزبور، علتی غیر از میگرن داشته و ممکن است نیاز به تصویربرداری عصبی باشد یا خیر.[۶] یکی دیگر از نشانههای لزوم تصویربرداری عصبی، جراحی استریوتاکتیک CT یا MRI یا PET جراحی رادیولوژیک برای درمان تومورهای داخل جمجمهای، ناهنجاریهای عروق کرونری و سایر شرایط قابل درمان توسط جراحی است. [۷][۸][۹][۱۰]
تکنیکهای تصویربرداری مغز
ویرایشتوموگرافی محوری محاسبهشده
ویرایشاسکن توموگرافی کامپیوتری (CT) یا توموگرافی محوری محاسبهشده (CAT) از یک سری پرتو ایکس حول سر بیمار از جهات مختلف استفاده میکند. سیتی اسکن، که بهطور معمول برای مشاهدهٔ سریع آسیبهای مغزی مورد استفاده قرار میگیرد، از یک برنامهٔ کامپیوتری بهره میگیرد که محاسبات یکپارچهٔ عددی (تبدیل رادیون معکوس) را بر روی یک سری اندازهگیری پرتو ایکس انجام میدهد، تا مشخص شود چه مقدار پرتو ایکس در حجم کوچکی از مغز، جذب شده است. بهطور معمول این اطلاعات به صورت قطعی از مغز ارائه میشوند.[۱۱]
تصویربرداری نوری پراکنده
ویرایشتصویربرداری نوری پراکنده (DOI) یا توموگرافی نوری پراکنده (DOT) یک روش تصویربرداری پزشکی است که از نور نزدیک به فروسرخ برای تولید تصاویری از بدن استفاده میکند. این روش میزان جذب نوری هموگلوبین را اندازهگیری کرده و بر طیف جذبی هموگلوبین که بسته به میزان اکسید شدن آن متفاوت است، تکیه دارد. با استفاده از بررسی واکنش به تحریک بصری در افراد مورد مطالعه با هر دو تکنیک، با نتایج کاملاً مشابه، توموگرافی نوری پراکنده (HD-DOT) مستقیماً با fMRI مقایسه شد.[۱۲] همچین HD-DOT از لحاظ وظایف زبانی و اتصال کارکردی حالت استراحت، با fMRI مقایسه شد.[۱۳]
سیگنال نوری رویداد-محور
ویرایشسیگنال نوری مربوط به رویداد (EROS) که با بهرهگیری از نور فروسرخ از طریق فیبرهای نوری، برای اندازهگیری تغییرات خواص اپتیکی مناطق فعال قشر مغزی، عمل میکند. درحالیکه تکنیکهایی مانند تصویربرداری نوری توزیع شده (DOT) و اسپکتروسکوپی نزدیک به فروسرخ (NIRS) به اندازهگیری میزان جذب نوری هموگلوبین پرداخته، و بنابراین بر اساس جریان خون هستند. EROS از خواص پراکندگی نورونها بهره گرفته و در نتیجه، اندازهگیری دقیقتری از فعالیت سلولی صورت میدهد. EROS میتواند به بررسی فعالیت مغز در چند میلیمتر (از نظر فضایی)، و در عرض چند میلیثانیه (از نظر زمانی)، اقدام نماید. بزرگترین ناکامی آن، عدم توانایی تشخیص فعالیت در عمقی بیش از چند سانتیمتر است. EROS یک روش جدید و نسبتاً ارزان است که به موضوع بررسی، آسیبی وارد نمیآورد. این فناوری در دانشگاه ایلینوی در اوربانا شامپاین ساخته شده است که در حال حاضر در آزمایشگاه شناختی عکسبرداری عصبی گابریل گراتون و مونیکا فابیاتی استفاده میشود.
تصویربرداری رزونانس مغناطیسی
ویرایشتصویربرداری رزونانس مغناطیسی (MRI) از میدان مغناطیسی و امواج رادیویی برای تولید تصاویر دوبعدی یا سهبعدی با کیفیت بالا از ساختار مغز بدون استفاده از پرتوهای یونیزان (پرتو ایکس) یا ردیابهای رادیواکتیو بهره میگیرد. در واقع امآرآی روشی است که از خاصیت مغناطیسی بافتها استفاده کرده و تولید تصویر میکند. اصول پایهٔ MRI بر این اساس است که هستههای بعضی از عناصر، وقتی در میدان مغناطیسی قوی قرار میگیرند، با نیروی مغناطیسی در یک راستا قرار میگیرند.
تصویربرداری رزونانس مغناطیسی عملکردی
ویرایشتصویربرداری رزونانس مغناطیسی عملکردی (fMRI) و برچسبگذاری فقراتی شریانی (ASL) بر خواص پارامغناطیسی هموگلوبین اکسید شده و دگزا اکسید شده، جهت مشاهدهٔ تصاویری از تغییر جریان خون در مغز، در ارتباط با فعالیت عصبی، متکی هستند. این امر، امکان تولید تصاویری در حین انجام وظایف مختلف یا حالت استراحت را میدهد، که منعکسکنندهٔ ساختارهای فعال مغزی (و چگونگی عملکرد آنها)، است. طبق فرضیهٔ اکسیژناسیون، تغییرات مصرف اکسیژن در جریان خون هر منطقه از مغز در طول فعالیت شناختی یا رفتاری را می توان با نورونهای منطقهای که در ارتباط مستقیم با وظایف شناختی و رفتاری مورد بررسی هستند، مرتبط دانست. بیشتر اسکنرهای FMRI این امکان را میدهند که در قالب تصاویر مختلف بصری، صداها و محرکهای لمسی و از طریق اقدامات مختلف، مانند فشار یک دکمه یا حرکت دادن یک جویاستیک ارائه شوند. در نتیجه، fMRI میتواند برای نشان دادن ساختارها و فرایندهای مغز مرتبط با ادراک، تفکر و عمل استفاده شود. وضوح fMRI در حال حاضر حدود ۲–۳ میلیمتر است که محدود به گسترش مکانی واکنش همودینامیک به فعالیت عصبی است. این فناوری به جهت مطالعهٔ الگوهای فعالسازی مغز تا حد زیادی جایگزین PET شده است. با این حال PET،از مزیت قابل توجه توانایی تصویرسازی لیگاندهای گیرنده رادیویی برخوردار است. (لیگاندهای گیرنده به هر مادهٔ شیمیایی گفته میشود که به گیرندهها میچسبد). fMRI علاوه بر زمینهٔ تحقیقات روی افراد سالم بهطور فزایندهای برای تشخیص پزشکی بیماریها نیز استفاده میشود. از آنجا که fMRI بهشدت به مصرف اکسیژن در جریان خون حساس است، به تغییرات اولیه ناشی از ایسکمی (جریان خون غیرطبیعی پایین) در مغز، مانند تغییرات ناشی از سکتهٔ مغزی، بسیار حساس است. تشخیص زودهنگام انواع خاصی از سکتهٔ مغزی در علم اعصاب بهطور فزایندهای مهم است، زیرا ممکن است در چند ساعت نخستِ پس از انواع خاصی از سکتهٔ مغزی، داروهای خاصی را استفاده نمود که قادر به باز کردن لختههای خون شود، اما استفاده از همان دارو، چند ساعت پس از آن خطرناک باشد. تغییرات مغزی دیده شده در fMRI میتواند به تصمیمگیری پزشک در درمان کمک کند. با توجه به دقت بین ۷۲٪ تا ۹۰٪ تکنیکهای fMRI[۱۴] با احتمال خطای تنها ۰٫۸٪، این تکنیکها میتوانند تصمیم بگیرند که کدام یک از مجموعه تصاویر شناختهشده مورد نظر است.[۱۵]
مغناطیس فلوگرافی
ویرایشMagnetoencephalography) MEG) یک روش تصویربرداری است که برای اندازهگیری میدان مغناطیسی تولید شده توسط فعالیت الکتریکی در مغز از طریق دستگاههای بسیار حساس مانند دستگاههای تداخل کوانتمی ابررسانا (SQUIDs) و مغناطیس سنجهای آزاد کننده اسپین تبادلگر اسپین[۱۶] (SERF) استفاده میشود. MEG (به عنوان مثال در مقایسه با fMRI) اندازهگیری بسیار مستقیم فعالیت الکتریکی عصبی را با رزولوشن زمانی بسیار بالا اما نسبتاً کم وضوح فضایی اندک، ارائه میدهد. مزیت اندازهگیری میدانهای مغناطیسی تولید شده توسط فعالیت عصبی این است که احتمال تخریب آنها توسط بافتهای اطراف (به ویژه جمجمه و پوست سر) نسبت به میدانهای الکتریکی اندازهگیری شده توسط الکتروانسفالوگرافی (EEG) کمتر است. به ویژه، میتوان نشان داد که میدان مغناطیسی ایجاد شده ناشی از فعالیت الکتریکی تحت تأثیر بافت اطراف سر قرار نمیگیرند، آن همزمانی که سر به عنوان مجموعه ای از پوستههای کروی متحرک مدلسازی میشود، که هر یک از آنها یک هادی همجنسگرای ایزوتروپیک است. سرهای سالم غیر کروی هستند و عمدتاً دارای رسانایی ناهمسانگرد هستند (خصوصاً ماده سفید و جمجمه). در حالی که ناهمسانگردی جمجمه اثرات ناچیزی بر MEG دارد (بر خلاف EEG)، ناهمسانگردی ماده سفید به شدت روی سنجش صورت گرفته توسط MEG برای منابع شعاعی و عمیق تأثیر میگذارد.[۱۷] با این حال توجه داشته باشید که در این مطالعه جمجمه به صورت یکنواخت ناهمسانگرد در نظر گرفته شده است، که برای یک سر واقعی اینطور نیست. ضخامت مطلق و نسبی لایههای diploe و لایههای جدولی در بین استخوانهای جمجمه و درون آنها متفاوت است. این باعث میشود که MEG نیز تحت تأثیر ناهمسانگردی جمجمه قرار گیرد،[۱۸] اگرچه احتمال تأثیرگذاری آن به اندازه EEG نیست. کاربردهای زیادی برای MEG وجود دارد، از جمله کمک به جراحان در تعیین محل آسیب، کمک به محققان در تعیین عملکرد بخشهای مختلف مغز، نوروفیدبک و غیره.
توموگرافی گسیل پوزیترون
ویرایشتوموگرافی انتشار پوزیترون (PET) و توموگرافی انتشارات پوزیترون مغز، به سنجش میزان انتشار مواد شیمیایی دارای متابولیسم فعال رادیواکتیوی که در جریان خون تزریق شده است، میپردازد. دادههای انتشار یافته برای تولید تصاویر دو -یا سه- بُعدی از توزیع مواد شیمیایی در مغز، به صورت کامپیوتری پردازش میشوند.[۱۹] : 57 رادیوایزوتوپهای انتشار پوزیترون با استفاده از یک سیکلوترون تولید میشوند و مواد شیمیایی با این اتمهای رادیواکتیو برچسب گذاری میشوند. ترکیب برچسب گذاری شده، به نام رادیوتراپی، به داخل جریان خون تزریق میشود و سرانجام راه خود را به مغز میرساند. سنسورهای اسکنر PET فعالیت رادیواکتیویته را به عنوان انباشتههایی ترکیبی در مناطق مختلف مغز تشخیص میدهند.کامپیوتر از دادههای جمعآوری شده توسط حسگرها برای ایجاد تصاویر رنگی ۲- و ۳ بعدی استفاده میکند که نشان دهنده محل عمل این ترکیب در مغز است. . به خصوص مجموعه ای گسترده از لیگاندهای برای نشان دادن جنبههای مختلف فعالیت انتقال دهنده عصبی، ضمن استفاده از ردیاب PET که فرم نشاندار شده از گلوکز است، مفید است. (نگاه کنید به Fludeoxyglucose (18F) (FDG)). بزرگترین مزیت اسکن PET این است که ترکیبات مختلف میتوانند جریان خون و اکسیژن و متابولیسم گلوکز را حین کار در بافتهای مغز نشان دهند. این اندازهگیریها نشان دهنده فعالیت مغز در مناطق مختلف آن بوده، و امکان آشنایی بیشتر با نحوه عملکرد مغز را فرآهم میآورد. اسکنهای PET، هنگامی که برای اولین بار ارائه شدند، از لحاظ رزولوشن و سرعت تکمیل (بازهٔ به کوچکی تنها ۳۰ ثانیه)، بسیار برتر از سایر روشهای تصویربرداری متابولیک بودند. وضوح بهبود یافته، امکان مطالعه بهتر منطقه مغزی فعال شده توسط یک کار خاص را فراهم میساخت. بزرگترین نقص اسکن PET این است که به علت از بین رفتن سریع ماده رادیواکتیویته، تنها امکان نظارت بر فعالیتهای کوتاه مدت وجود دارد.[۲۰] : 60 قبل از اینکه تکنولوژی fMRI به صورت آنلاین وارد شود، اسکن PET، روش ترجیحی تصویربرداری مغزی کارکردی (به جای ساختاری) بوده، همچنان نیز در علوم اعصاب نقش بزرگی دارد. از اسکن PET در تشخیص بیماریهای مغزی نیز استفاده میشود، بیشتر به این خاطر که تومورهای مغزی، سکته مغزی و بیماریهای آسیب زننده به نورون، که سبب زوال عقل میشوند (مانند بیماری آلزایمر)، باعث تغییرات زیادی در متابولیسم مغز میشوند که به نوبهٔ خود باعث ایجاد تغییرات قابل تشخیص در PET میشوند. احتمالاً PET بیشتر در موارد ابتدایی برخی عارضههای مغزی (که از موارد قدیمی و شایع آن میتوان به بیماری آلزایمر و بیماری Pick نام برد) مفید است، که آسیب اولیه آنها بسیار پراکنده بوده و باعث کاهش بسیار زیادی در حجم مغز و ساختار ناخالص آن میشود، بگونه ای که باعث ایجاد تغییر قابل توجه در تصاویر CT و MRI استاندارد گشته، بگونه ای که بهطور طبیعی قابل تفکیک نسبت به حالت "طبیعی و نرمال" آتروفی قشر مغز باشد، که با پیری (در بسیاری، اما نه همه) افراد صورت پذیرفته، و الزاماً به ضایعه مغزی بالینی نمیانجامد.
توموگرافی کامپیوتری با انتشار تک فوتون
ویرایشتوموگرافی کامپیوتری با انتشار تک فوتون (SPECT) شبیه به PET است و از رادیو ایزوتوپهای گاما اشعه گاما و یک دوربین گاما برای ضبط دادههایی استفاده میکند که کامپیوتر برای ساخت تصاویر دو یا سه بعدی از مناطق فعال مغز استفاده میکند.[۲۱] SPECT مبتنی بر تزریق تستر رادیواکتیو یا "عامل SPECT" است که به سرعت توسط مغز به جذب میشود اما مجدداً توزیع نمیشود. جذب عامل SPECT تقریباً بهطور ۱۰۰٪ کامل در عرض ۳۰ تا ۶۰ ثانیه عمل کرده، که منعکسکننده جریان خون مغزی (CBF) در زمان تزریق میباشد. این خواص SPECT آن را به خصوص برای تصویربرداری صرع مناسب میکند، که معمولاً با مشکلاتی که در حرکت بیمار و تنوع انواع تشنج کار را مشکل میسازد. SPECT یک تصویر "فوری" از جریان خون مغزی فراهم میآورد، زیرا اسکن میتواند پس از فیکس شدن تشنج به دست آید (تا زمانی که تکرار رادیواکتیو در هنگام تشنج تزریق شود). محدودیت قابل توجهی از SPECT را میتوان رزولوشن پایین آن (حدود 1 cm) در مقایسه با MRIدانست. امروزه ماشینهای SPECT با سرهای تشخیصی دوگانه مورد استفاده قرار میگیرند، هرچند دستگاههای Triple Detector Head نیز در بازار موجود است. بازسازی تاموگرافی (عمدتاً برای گرفتن «عکسهای فوری» از مغز استفاده میشود)، مستلزم عکسبرداریهای متعدد توسط سرهای دستگاه است که اطراف جمجمه انسان در چرخشند؛ بنابراین، برخی محققان، از دستگاههایی با ۶ و ۱۱ سَری، به منظور کاهش زمان تصویربرداری و ارائه رزولوشن بالاتر، بهره میگیرند.[۲۲][۲۳] مانند PET، دستگاه SPECT نیز میتواند برای ایجاد تمایز میان انواع فرایندهای بیماری که منجر به ایجاد زوال عقل میشود، مورد استفاده قرار میگیرد. Neuro-PET متأسفانه مجبور به استفاده از ردیابهای با نیمه عمر حداکثر ۱۱۰ دقیقه، مانند FDG میباشد. اینها باید در یک سیکلوترون ساخته شوند و گرانقیمت باشند یا حتی در دسترس نباشد، در صورتی که زمان حمل و نقل بیش از چند نیم عمر باشد، گران تمام شده، یا حتی مقدور نیستند. با این حال، SPECT، قادر به استفاده از ردیابهای با نیمه عمر طولانیتر، مانند تکنسیوم 99m است، و در نتیجه، بهطور گستردهای در دسترس است.
مزایا و نگرانیهای تکنیکهای تصویربرداری عصبی
ویرایشتصویربرداری رزونانس مغناطیسی کاربردی (fMRI)
ویرایشfMRI در مقایسه با سایر روشهای تصویربرداری، بهطور معمول در گروه دستگاههای دارای خطر اندک تا متوسط جای میگیرد. fMRI از کنتراست وابسته به سطح اکسیژن خون (BOLD)به منظور تولید شکل خود از تصویربرداری بهره میگیرد. کنتراست BOLD یک فرایند طبیعی در بدن است، به طوری که fMRI نسبت به اغلب روشهای تصویربرداری که برای نشان دادن تصویربرداریهای مشابه نیازمند نشانگرهای رادیواکتیو میباشند، برتری دارد.[۲۴] یک نگرانی در استفاده از fMRI، استفاده از آن در افراد دارای ایمپلنتهای پزشکی یا دستگاهها و اقلام فلزی در بدن، میباشد. رزونانس مغناطیسی (MR) انتشار یافته از دستگاه میتواند سبب ایجاد اختلال در دستگاههای پزشکی، و جذب اشیاء فلزی موجود در بدن گردد. در حال حاضر FDA ایمپلنتهای پزشکی و دستگاه را طبق سازگاری MR طبقهبندی میکند:
MR-safe: امن در تمام محیطهای (MR)
MR-unsafe: نا امن در هر محیط (MR)
MR-conditional: سازگار با MR در محیطهای خاص، نیاز به اطلاعات بیشتر). +++*
.[۲۵]
- <span data-segmentid=
توموگرافی کامپیوتری (CT Scan)
ویرایشسی تی اسکن در دهه ۱۹۷۰ ارائه شده، و به سرعت به یکی از روشهای پرکاربرد تصویربرداری تبدیل شد. یک CT اسکن میتواند ظرف یک ثانیه انجام شده و نتایج آن سریعاً به پزشکان ارائه شود. سهولت استفاده، منجر به افزایش استفاده از سی تی اسکن در ایالات متحده -از ۳ میلیون در سال ۱۹۸۰ به ۶۲ میلیون در سال ۲۰۰۷- شده است. پزشکان اغلب اسکنهای چندگانه ای میگیرند، بهطوری که حدود ۳۰٪ از افراد تحت مطالعه، هر یک حداقل ۳ اسکن CT اسکن داشتهاند. .[۲۶] سی تی اسکنها میتوانند بیماران را در معرض تابش اشعه ای ۱۰۰ تا ۵۰۰ برابر بیشتر از اشعههای X-ray سنتی قرار دهند. این در حالیست که دوزهای بالای تابش، تصاویری با رزولوشن بالاتر به نمایش میگذارند.[۲۷] در حالی که استفاده آسان از آن، منجر به افزایش استفاده از سی تی اسکن، به ویژه در بیماران بدون علائم میگردد، اما قرار گرفتن بیماران در معرض سطح قابل توجهی از تابش، را میتوان دغدغه بزرگی دانست. ++*
.[۲۶]
توموگرافی انتشار پوزیترون (PET)
ویرایشدر اسکن PET، تصویربرداری به فرایندهای بیولوژیکی درونی متکی نیست، بلکه به یک ماده خارجی تزریق شده به جریان خون، که به مغز منتقل میشود، وابسته است. رادیوایزوتوپهایی به بیماران تزریق میشوند که در مغز متابولیزه شده، و پوزیترونها را برای تولید تصویر از فعالیت مغز، منتشر میسازد.. رادیوایزوتوپهایی به بیماران تزریق میشوند که در مغز متابولیزه شده، و پوزیترونها را برای تولید تصویر از فعالیت مغز، منتشر میسازد. در مقایسه با حجم تابش محیطی فرد در یک یک سال، مقدار تابشی که بیمار در یک اسکن PET دریافت میکند، نسبتاً اندک است. رادیو ایزوتوپهای PET مدت زمان در معرض قرارگیری محدودی در بدن دارند، زیرا عموماً نیمه عمرشان کوتاه (~ ۲ ساعت) بوده، و به سرعت از بین میروند.[۲۸] در حال حاضر، fMRI یکی از روشهای مرجّح تصویربرداری از فعالیت مغز -در مقایسه با PET- است، زیرا فاقد تابش بوده، رزولوشن زمانی بالاتری نسبت به PET داشته، و در اکثر زمینههای پزشکی، قابل دسترس تر است.
مگنتوآنسفالوگرافی (MEG) و الکتروانسفالوگرافی (EEG)
ویرایشرزولوشن زمانی بالای MEG و EEG، به این روشها امکان اندازهگیری فعالیت مغز تا سطح میلی ثانیه را میدهد. هر دو MEG و EEG برای عملکرد خود، نیازی به قرار گرفتن بیمار در معرض تابش ندارند. الکترودهای EEG، سیگنالهای الکتریکی تولید شده توسط نورونها را برای اندازهگیری فعالیت مغز تشخیص داده، و MEG نیز با استفاده از نوسانات میدان مغناطیسی تولید شده توسط این جریان الکتریکی، به اندازهگیری فعالیت میپردازد. مهمترین مانع موجود در استفاده گسترده از MEG، قیمت آن است، چراکه سیستمهای MEG میتوانند میلیونها دلار هزینه داشته باشند. EEG روش متداول تری برای دستیابی به چنین رزولوشن زمانی است، زیرا سیستمهای EEG هزینه بسیار کمتری نسبت به سیستمهای MEG برمیدارند. ناکارآمدی EEG و MEG در این است که هر دو روش، از رزولوشن فضایی ضعیفی نسبت به fMRI برخوردارند.[۲۹]
انتقاد و هشدارها
ویرایشبرخی از دانشمندان از ادعاهای صورت گرفته در نشریات، مجلات علمی و مطبوعات مردمی، در ارتباط با تصویربرداری از مغز مانند کشف "بخشی از مغز مسئول" برای عملکردهایی مانند استعدادها، خاطرات خاص یا ایجاد احساسات مانند عشق، انتقاد کردهاند. بسیاری از تکنیکهای نقشهبرداری دارای رزولوشن نسبتاً کم هستند، از جمله صدها هزار نورون در واکسل واحد. بسیاری از کارکردها نیز مستلزم استفاده از بخشهای مختلفی از مغز هستند، به این معنی که این نوع ادعا احتمالاً با تجهیزات مورد استفاده قابل تبیین نبوده، و عموماً بر اساس یک تصور اشتباه در مورد نحوه تقسیم کارکرد مغز است.ممکن است چه بسا که بیشتر کارکردهای مغز، تنها پس از اندازهگیریهای بسیار ریز و دقیق تری اندازهگیری شوند، که نه به مناطق بزرگی از مغز، بلکه به تعداد بسیار زیادی از مدارهای مغزی کوچک انسان، محدود میشوند. بسیاری از این مطالعات همچنین دارای مشکلاتی فنی، همچون اندازه کوچک نمونه، یا کالیبراسیون ضعیف تجهیزات هستند؛ به این جهت، قابل تعمیم نمیباشند -ملاحظاتی که گاهی نادیده گرفته میشوند تا بتوان مقاله یا سرفصل اخباری جنجالی تولید نمود. در برخی موارد، تکنیکهای نقشهبرداری مغز، با اهداف تجاری، گاه جهت تشخیص دروغ، یا گاه به منظور تشخیص پزشکی به روشهایی که از لحاظ علمی مورد تأیید قرار نیستند، مورد استفاده قرار میگیرند.
جستارهای وابسته
ویرایش- نگاشت مغزی
- Connectogram
- Functional integration (neurobiology)
- طیفنگاری کارکردی فروسرخ نزدیک
- تصویربرداری عصبی کارکردی
- History of neuroimaging
- مغز انسان
- List of neuroimaging software
- List of neuroscience databases
- امآرآی
- مگنتوانسفالوگرافی
- Medical image computing
- تصویربرداری پزشکی
- Neuroimaging journals
- Statistical parametric mapping
- تحریک مغناطیسی مغز
- Voxel-based morphometry
منابع
ویرایش- ↑ Filler, Aaron (12 July 2009). "The History, Development and Impact of Computed Imaging in Neurological Diagnosis and Neurosurgery: CT, MRI, and DTI". Nature Precedings. doi:10.1038/npre.2009.3267.5.
- ↑ Sandrone S, Bacigaluppi M, Galloni MR, Martino G (November 2012). "Angelo Mosso (1846-1910)". Journal of Neurology. 259 (11): 2513–4. doi:10.1007/s00415-012-6632-1. PMID 23010944.
- ↑ Sandrone S, Bacigaluppi M, Galloni MR, Cappa SF, Moro A, Catani M, Filippi M, Monti MM, Perani D, Martino G (February 2014). "Weighing brain activity with the balance: Angelo Mosso's original manuscripts come to light". Brain. 137 (Pt 2): 621–33. doi:10.1093/brain/awt091. PMID 23687118.
- ↑ Miller, Thomas H.; Kruse, Jerry E. (2005-10-15). "Evaluation of syncope". American Family Physician. 72 (8): 1492–1500. ISSN 0002-838X. PMID 16273816.
- ↑ American College of Physicians (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American College of Physicians, archived from the original on 1 September 2013, retrieved 10 December 2013, which cites
- ↑ ۶٫۰ ۶٫۱ ۶٫۲ American Headache Society (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Headache Society, archived from the original on 3 December 2013, retrieved 10 December 2013, which cites
- ↑ Thomas DG, Anderson RE, du Boulay GH (January 1984). "CT-guided stereotactic neurosurgery: experience in 24 cases with a new stereotactic system". Journal of Neurology, Neurosurgery, and Psychiatry. 47 (1): 9–16. doi:10.1136/jnnp.47.1.9. PMC 1027634. PMID 6363629.
- ↑ Heilbrun, M. P.; Sunderland, P. M.; McDonald, P. R.; Wells, T. H.; Cosman, E.; Ganz, E. (1987). "Brown-Roberts-Wells stereotactic frame modifications to accomplish magnetic resonance imaging guidance in three planes". Applied Neurophysiology. 50 (1–6): 143–152. doi:10.1159/000100700. ISSN 0302-2773. PMID 3329837.
- ↑ Leksell L, Leksell D, Schwebel J (January 1985). "Stereotaxis and nuclear magnetic resonance". Journal of Neurology, Neurosurgery, and Psychiatry. 48 (1): 14–8. doi:10.1136/jnnp.48.1.14. PMC 1028176. PMID 3882889.
- ↑ Levivier M, Massager N, Wikler D, Lorenzoni J, Ruiz S, Devriendt D, David P, Desmedt F, Simon S, Van Houtte P, Brotchi J, Goldman S (July 2004). "Use of stereotactic PET images in dosimetry planning of radiosurgery for brain tumors: clinical experience and proposed classification". Journal of Nuclear Medicine. 45 (7): 1146–54. PMID 15235060.
- ↑ Jeeves, Malcolm A. (1994). Mind Fields: Reflections on the Science of Mind and Brain. Grand Rapids, MI: Baker Books. p. 21.
- ↑ Eggebrecht AT, White BR, Ferradal SL, Chen C, Zhan Y, Snyder AZ, Dehghani H, Culver JP (July 2012). "A quantitative spatial comparison of high-density diffuse optical tomography and fMRI cortical mapping". NeuroImage. 61 (4): 1120–8. doi:10.1016/j.neuroimage.2012.01.124. PMC 3581336. PMID 22330315.
- ↑ Eggebrecht AT, Ferradal SL, Robichaux-Viehoever A, Hassanpour MS, Dehghani H, Snyder AZ, Hershey T, Culver JP (June 2014). "Mapping distributed brain function and networks with diffuse optical tomography". Nature Photonics. 8 (6): 448–454. doi:10.1038/nphoton.2014.107. PMC 4114252. PMID 25083161.
- ↑ Smith, Kerri (March 5, 2008). "Mind-reading with a brain scan". Nature News. Nature Publishing Group. Retrieved 2008-03-05.
- ↑ Keim, Brandon (March 5, 2008). "Brain Scanner Can Tell What You're Looking At". Wired News. CondéNet. Retrieved 2015-09-16.
- ↑ Boto, Elena; Holmes, Niall; Leggett, James; Roberts, Gillian; Shah, Vishal; Meyer, Sofie S.; Muñoz, Leonardo Duque; Mullinger, Karen J.; Tierney, Tim M. (March 2018). "Moving magnetoencephalography towards real-world applications with a wearable system". Nature (به انگلیسی). 555 (7698): 657–661. doi:10.1038/nature26147. ISSN 1476-4687.
- ↑ Wolters CH, Anwander A, Tricoche X, Weinstein D, Koch MA, MacLeod RS (April 2006). "Influence of tissue conductivity anisotropy on EEG/MEG field and return current computation in a realistic head model: a simulation and visualization study using high-resolution finite element modeling". NeuroImage. 30 (3): 813–26. doi:10.1016/j.neuroimage.2005.10.014. PMID 16364662.
- ↑ Ramon C, Haueisen J, Schimpf PH (October 2006). "Influence of head models on neuromagnetic fields and inverse source localizations". Biomedical Engineering Online. 5 (1): 55. doi:10.1186/1475-925X-5-55. PMC 1629018. PMID 17059601.
- ↑ Nilsson, Lars-Goran; Markowitsch, Hans J. (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers.
- ↑ Nilsson, Lars-Goran; Markowitsch, Hans J. (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers.
- ↑ تصویر برداری مغز فلیپ توپ توضیح داده شده است
- ↑ "SPECT Systems for Brain Imaging". Retrieved July 24, 2014.
- ↑ "SPECT Brain Imaging". Retrieved January 12, 2016.
- ↑ Crosson B, Ford A, McGregor KM, Meinzer M, Cheshkov S, Li X, Walker-Batson D, Briggs RW (2010). "Functional imaging and related techniques: an introduction for rehabilitation researchers". Journal of Rehabilitation Research and Development. 47 (2): vii–xxxiv. PMC 3225087. PMID 20593321.
- ↑ Tsai LL, Grant AK, Mortele KJ, Kung JW, Smith MP (October 2015). "A Practical Guide to MR Imaging Safety: What Radiologists Need to Know". Radiographics. 35 (6): 1722–37. doi:10.1148/rg.2015150108. PMID 26466181.
- ↑ ۲۶٫۰ ۲۶٫۱ Brenner DJ, Hall EJ (November 2007). "Computed tomography--an increasing source of radiation exposure". The New England Journal of Medicine. 357 (22): 2277–84. doi:10.1056/NEJMra072149. PMID 18046031.
- ↑ Smith-Bindman R (July 2010). "Is computed tomography safe?". The New England Journal of Medicine. 363 (1): 1–4. doi:10.1056/NEJMp1002530. PMID 20573919.
- ↑ ۲۸٫۰ ۲۸٫۱ Crosson B, Ford A, McGregor KM, Meinzer M, Cheshkov S, Li X, Walker-Batson D, Briggs RW (2010). "Functional imaging and related techniques: an introduction for rehabilitation researchers". Journal of Rehabilitation Research and Development. 47 (2): vii–xxxiv. PMC 3225087. PMID 20593321.
- ↑ Crosson B, Ford A, McGregor KM, Meinzer M, Cheshkov S, Li X, Walker-Batson D, Briggs RW (2010). "Functional imaging and related techniques: an introduction for rehabilitation researchers". Journal of Rehabilitation Research and Development. 47 (2): vii–xxxiv. PMC 3225087. PMID 20593321.
- ↑ Satel, Sally; Lilienfeld, Scott O. (2015). Brainwashed: The Seductive Appeal of Mindless Neuroscience. Basic Books. ISBN 978-0-465-06291-1.
لینکهای خارجی
ویرایش- کل مغز اطلس @ هاروارد
- یادداشتهای سخنرانی در مورد جنبههای ریاضی نقض عصبی توسط ویل پنی، دانشگاه کالج لندن
- "تحریک مغناطیسی ترانس مغناطیسی". توسط مایکل Leventon در ارتباط با آزمایشگاه MIT AI.
- NeuroDebian - یک سیستم عامل کامل برای طراحی عصبی است