پیل برقشیمیایی
این مقاله نیازمند بررسی توسط یک متخصص است. لطفاً پارامتر دلیل یا بحث در این الگو را برای مشخصکردن مشکل مقاله استفاده کنید. |
پیل الکتروشیمیایی (به انگلیسی: Electrochemical cell) پیلی است که در آن در اثر واکنش شیمیایی، جریان الکتریکی تولید میشود یا واکنشی شیمیایی بوسیله انرژی الکتریکی انجام میشود. باتریهای ۵/۱ ولت معمولی نمونهای از یک پیل الکتروشیمیاییاند.[۱][۲] (گرچه که به بیان درستتر یک پیل گالوانیکاند.)
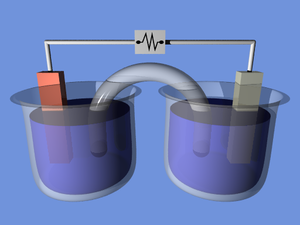
بخش ها
ویرایشپیل الکتروشیمیایی چهار بخش دارد:
- آند: که در آن واکنش آندی رخ میدهد.
- کاتد: که در ان واکنش کاتدی رخ میدهد. کاتد بخشی از سطح است که هدایت الکتریکیاش بالا باشد و قابلیت انجام واکنش آن بالا باشد. برای مثال در چدن خاکستری گرافیتهای سطح کاتداند.[۳]
- الکترولیت: که برای رخ دادن واکنش بین آند و کاتد است و باید هدایت الکتریکیاش بالا باشد. الکترولیت میتواند محلول ۰۰۰۱/۰ نمک خوراکی یا محلول نمکین آب دریا باشد.
- پل: که بین آند و کاتد اتصال الکتریکی برای جابجایی الکترون برقرار میکند.
در پیل الکتروشیمیایی بایستی سرعت زایش و گیرش الکترون برابر باشد.
جستارهای وابسته
ویرایشمنابع
ویرایش- ↑ Wenzel, Thomas J. (2013-07-30). "Douglas A. Skoog, Donald M. West, F. James Holler, and Stanley R. Crouch: Fundamentals of analytical chemistry, 9th ed., international ed". Analytical and Bioanalytical Chemistry. 405 (25): 412–432. doi:10.1007/s00216-013-7242-1. ISSN 1618-2642. S2CID 94566587.
- ↑ Wendt, Hartmut; Kolb, Dieter M.; Engelmann, Gerald E.; Ziegler, Jörg C. (2011-10-15), "Electrochemistry, 1. Fundamentals", in Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann's Encyclopedia of Industrial Chemistry (به انگلیسی), Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. a09_183.pub4, doi:10.1002/14356007.a09_183.pub4, ISBN 978-3-527-30673-2, retrieved 2023-05-05
- ↑ Chemistry, Rice University, 2015. [Online]. Available: https://web.ung.edu/media/Chemistry2/Chemistry-LR.pdf