سلولزدایی
سلولزدایی (به انگلیسی: Decellularization)، فرایندی است مورد استفاده در مهندسی زیستپزشکی که به منظور جداسازی ماتریکس برونیاختهای از سلولهای مستقر در یک بافت انجام میشود. این فرایند میتواند منجر به ایجاد داربستهای طبیعی گردد که در ساخت اندامهای مصنوعی و ترمیم بافت کاربرد دارد. پیوند اندام و بافت گسترهٔ بزرگی از چالشهای پزشکی از نارسایی اعضای بدن تا جراحیهای پلاستیک را برطرف میکند. یکی از مهمترین محدودیتهای مواجهه در پیوند عضو، رد پیوند به علت واکنش شکل گرفته بین پادتنهای بدن گیرنده و آنتیژنهای موجود در سطح سلولهای عضو پیوندی است.[۱] به دلیل پاسخهای ایمنی نامساعد، بیماران پیوندی ملزم به دریافت داروهای سرکوبکنندهٔ سیستم ایمنی در تمام طول عمر میشوند. استفان ف. بادیلک (به انگلیسی: Stephen F. Badylak) بنیانگذار فرایند سلولزدایی درموسسهٔ مک گوآن بخش پزشکی بازساختی دانشگاه پیتسبورگ است.[۲] طی این روند، زیست مادهای طبیعی حاصل میگردد که میتواند به عنوان داربستی برای رشد و تمایز سلولی و نیز توسعهٔ بافتی عمل کند. چنانچه به این داربست عاری از سلول، مجدداً سلولهای خود بیمار وارد شود، پاسخهای ایمنی نامساعد به حداقل خود خواهد رسید. امروزه، داربستهای ماتریکس برونیاختهای در سراسر جهان به فروش میرسند.
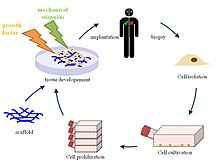
با توجه به کاربرد گستردهٔ سلولزدایی در درمان، روشهای شیمیایی، فیزیکی و آنزیمی به دقت به کار گرفته میشوند تا از صحت ساختاری و شیمیایی داربستها و مطابقت آن با بافت اصلی اطمینان حاصل شود.[۲] محققان میتوانند با استفاده از سلولهای پیشساز و سلولهای بنیادی بالغ و تمایز دادن آنها در داربستهای ماتریکس برونیاختهای، بافت و اندام مورد نظرشان را ایجاد کنند و به بیمار پیوند بزنند. علیرغم آنتیژنهای سطح سلول، اجزای زیستشیمیایی موجود در ماتریکس برونیاختهای میزبانهای مختلف، یکسان بوده و پاسخ ایمنی چندانی را به همراه ندارد.[۳][۴] تلاش برای حفظ ساختاری و شیمیایی فیبرها، فاکتورهای رشد و سایر پروتئینهای ماتریکس برونیاختهای در این فرایند، جهت تمایز موفق سلولهای پیشساز، لازم است. موفقیت سلولزدایی بستگی به منشأ بافت اصلی، اجزا و چگالی آن دارد.[۵] در حال حاضر، این روش در ساخت داربستهای زیستی برای بازسازی بافتهای قلبی، پوستی، تنفسی، کلیوی و غیره حاضر است و ساخت کامل اندام هم در مراحل اولیهٔ پیشرفت است. (در سال ۲۰۱۱)[۶]
طرح کلی روند سلولزدایی ویرایش
محققان میتوانند بافت مورد نظرشان را از فرد اهداکننده یا جسد استخراج کنند. سپس سلولهای موجود را بدون آسیب رساندن به ماتریکس برونیاختهای از بین ببرند و در نهایت داربستی از جنس ماتریکس با همان کارایی فیزیکی و بیوشیمیایی بافت اصلی بسازند.[۲] میتوان سلولهای بنیادی و پیشساز فرد میزبان را وارد این داربست کرد تا به سلولهای اصلی تمایز یابند. از آن جایی که آنتیژنهای سلولی فرد اهداکننده با حذف سلولها از بین رفتهاند، پاسخ ایمنی در بدن گیرنده ناچیز است. این فرایند همچنان در حال تکامل است. به دلیل تفاوتها و کاربردهای متنوع بافتها در بدن، تکنیکهای مورد استفاده برای هر بافت اختصاصی است. سلولزدایی، میتواند روند فیزیکی، شیمیایی یا آنزیمی را داشته باشد. اگرچه ممکن است یکی از این روشها بیشتر استفاده شود، اما کاربرد و منشأ بافت است که تعیین میکند چه ترکیبی از متدها کارساز است.[۵]
در مواجهه با محلولهای شیمیایی و آنزیمها، دو تکنیک وجود دارد. تکنیک تزریق داخل رگی مخصوص بافتهایی با سیستم خونرسانی و رگی گسترده نظیر قلب و ریه است. لازم است که سلولها در تمام عمقهای بافتی از بین بروند.[۷][۸] بنابراین میتوان مواد شیمیایی و آنزیمهای مخرب سلولی را داخل رگ تزریق کرد تا تحت این مکانیسم و شرایط فیزیولوژیک مناسب، از رگ به بیرون منتشر شوند و بهطور یکسان به تمام نقاط بافت بروند که در نهایت از طریق سیاهرگهای موجود از بافت خارج میشوند. تکنیک بعدی، سلولزدایی با غوطهورسازی (به انگلیسی: Immersion) است که طی آن بافت را بهطور کامل وارد محلول شیمیایی و آنزیمی میکنند. اگرچه این تکنیک آسانتر است اما مختص بافتهای نازک با سیستم خونرسانی ضعیف است.
روشهای فیزیکی ویرایش
متداولترین روشهای فیزیکی برای حذف و مرگ سلولها استفاده از دما، نیرو، فشار و الکتریسیته است. روشهای دمایی عمدتاً بر اساس مکانیسم انجماد و ذوب سریع است. با انجماد سریع بافت، کریستالهای یخی میکروسکوپی اطراف غشای پلاسمایی تشکیل گشته که منجر به لیز سلول میگردد.[۹] سپس بافت در معرض محلولهای شیمیایی قرار میگیرد تا اجزای زائد و نامطلوب از آن پاکسازی شود. این روش اگرچه باعث حفظ ساختار فیزیکی داربست ماتریکس برونیاختهای میشود اما بهترین نتیجه را در بافتهای ضخیم و قوی میدهد.
فشار هیدواستاتیک کنترل شده ناشی از اعمال نیرو بهطور حتم باعث خرابی ساختار ماتریکس برونیاختهای خواهد شد. این روش برای کارایی بهتر باید در دمای بالا انجام شود تا از تشکیل کریستالهای یخی کنترل نشده و تخریب بافت، اجتناب شود. همچنین میتوان بافت را در معرض پالس الکتریکی قرار داد تا منافذ میکروسکوپی در غشای پلاسمایی سلولها ایجاد شود که سرانجام سلولها بر اثر به هم ریختن تعادل همئوستاتیک از بین میروند. این فرایند، الکتروپوریشن غیرقابل بازگشت غیردمایی (به انگلیسی: Non-thermal irreversible electroporation (NTIRE)) نامیده میشود و کاربردش محدود به بافتهای نازک است. در شرایط درونتنی (in vivo) نیز اعمال جریان الکتریکی با محدودیت مواجه است.[۲]
روشهای شیمیایی ویرایش
ترکیب صحیحی از مواد شیمیایی جهت سلولزدایی با توجه به ضخامت بافت، ترکیب ماتریکس برونیاختهای و هدف اندام یا بافت انتخاب میشود. برای مثال، از آنزیمها نمیتوان در بافتهای کلاژندار استفاده کرد چرا که باعث از بین رفتن فیبرهای بافت همبند میشوند. با این حال، اگر میزان کلاژن بالا نباشد یا وجودش اهمیتی نداشته باشد، آنزیم کاربرد خواهد داشت. مواد شیمیایی مورد استفاده در سلولزدایی شامل شویندههای یونی، غیریونی و زویتریون است.
سدیم دودسیل سولفات به اختصار SDS با فرمول CH3(CH2)11SO4 Na، شویندهٔ یونی پرکاربردی است که تأثیر به سزایی در لیز سلولی بدون وارد کردن آسیب چندان به ماتریکس دارد.[۱۰][۱۱][۱۲] مکانیسم کارش به این شکل است که ابتدا این شوینده غشای سلولی را تخریب میکند. سپس اندونوکلئازها و اگزونوکلئازها محتوای ژنتیکی سلولها را از بین میبرند و سایر اجزای سلولی هم حل شده و از ماتریکس شسته میشوند. آلکالین و مواد اسیدی بهترین همراه برای SDS هستند زیرا توانایی تخریب اسیدهای نوکلئیک و حل کردن محتویات سیتوپلاسمی را در خود دارند.[۵]
تریتون ایکس-۱۰۰ و به فرمول (C14H22O(C2H4O)n) معروفترین شویندهٔ غیریونی است که در سلولزدایی هم کاربرد گستردهای دارد. این شوینده قادر است برهمکنش بین لیپیدها و بین لیپیدها و پروتئینها را از بین ببرد. اما تأثیری در برهمکنش بین پروتئینها ندارد که برای حفظ ساختار ماتریکس برونیاختهای مفید است.
اتیلندیآمینتترااستیک اسید به اختصار EDTA و به فرمول C10H16N2O8 عاملی چنگالنده (به انگلیسی: chelating agent) است یعنی میتواند با اتصال به یک یون فلزی، ساختار حلقهای پایدارتر تشکیل دهد. این ماده به یون کلسیم، عنصر لازم برای برهمکنش بین پروتئینها، متصل میگردد و آن را از دسترس خارج میکند و بدین ترتیب پروتئینهای غشای سراسری وابسته به کلسیم که در اتصالات بین سلولی شرکت میکنند، از کار میافتند. EDTA اغلب با تریپسین در سلولزدایی اسفاده میشود. تریپسین پروتئازی است که پیوند موجود بین پروتئینهای غشای سراسری سلولها و اتصال سلولی را از بین میبرد.
روشهای آنزیمی ویرایش
آنزیمهای مورد استفاده در سلولزدایی به منظور شکستن پیوندها و برهمکنشهای موجود بین اسیدهای نوکلئیک، سلولها (از طریق پروتئینهای غشای سراسری)، و سایر اجزای سلولی هستند. لیپازها، ترمولیزین، گالاکتوزیدازها، نوکلئازها و تریپسین همگی به کار گرفته میشوند. بعد از اینکه لیز سلولی بر اثر شویندهها، اسید، فشار فیزیکی و … اتفاق افتاد، اندونوکلئاز و اگزونوکلئازها وارد عمل میشوند تا محتویات ژنتیکی را از بین ببرند. اندونوکلئازها، دیانای و آرانای را در وسط توالیشان برش میزنند. بنزوناز (به انگلیسی: Benzonase) اندونوکلئازی است که میتواند قطعات کوچک نوکلئوتیدی متعددی تولید کند که در ادامه از ماتریکس حذف میشوند.[۱۳] اگزونوکلئازها پیوند فسفودیاستر را از انتهای توالی دیانای از بین میبرند و قطعهای از انتها بهدست میآید.
تریپسین، پروتئازی است که برهمکنش بین پروتئینها را تخریب میکند. اگرچه تریپسین میتواند تأثیر نامطلوبی روی فیبرهای کلاژن و الاستین ماتریکس برونیاختهای داشته باشد، اما استفاده از آن به شیوهٔ حساس به زمان، خرابیهای ممکن را کنترل میکند. آنزیم دیسپاز (به انگلیسی: Dispase) جهت جلوگیری از تجمع سلولی به کار گرفته میشود که برای جداسازی سلولها از ماتریکس برونیاختهای مفید است. آزمایشها نشان دادهاند که دیسپاز، مناسب سطح بافتهای با ضخامت کم است مانند ریه. برای حذف سلولهای عمقیتر، تحریک مکانیکی هم باید وارد روند گردد.
کلاژناز تنها زمانی استفاده میشود که برایمان مهم نباشد داربست نهایی، ساختار کلاژنی سالم داشته باشد. لیپازها عمدتاً زمانی کاربرد دارند که به پیوند پوست بدون سلول نیاز باشد. اسید لیپازها سلولزدایی بافت درمی را از طریق تجزیهٔ لیپید و از بین بردن برهمکنش بین سلولهای غنی از لیپید انجام میدهند. آنزیم آلفا-گالاکتوزیداز هم موجب حذف اپیتوپ گال که مربوط به آنتیژن ساختارهای دارای کربوهیدرات بر سطح سلول است، میشود.[۵]
کاربردها ویرایش
داربستهای طبیعی که از جنس ماتریکس برونیاختهای هستند و طی سلولزدایی بافتی حاصل میگردند، محیط فیزیکی و زیستشیمیایی لازم جهت تسهیل رشد و تمایز سلولهای پیشساز و بنیادی را فراهم میکنند. این داربستها، در هر دو شرایط درون آزمایشگاهی (in vitro) و درون جانداری (in vivo) به دست آمدهاند.[۶] کارآمدترین بافتهای سلولزدایی شده مربوط به بافتهایی است که سلولها عمدتاً دستخوش تقسیمات متقارن میگردند و تمایز چندانی وجود ندارد نظیر استخوان و پیوندهای درمی. با این حال، تحقیقات در حد مرحلهٔ تولید اندام در حال پیشرفت است.
ماتریکسهای بدون سلول درمی، کاربردهای زیادی پیدا کردهاند. برای مثال، پیوندهای پوستی در جراحیهای پلاستیک و درمان سوختگی استفاده میشود که علاوه بر حمایت فیزیکی ناحیهٔ آسیب دیده، موجب برانگیختن توسعهٔ بافت همبند پیوندی نیز میشود. در قلب نیز، شاهد موفقیت در خصوص ایجاد دریچههای سالم قلبی از ماتریکسهای طبیعی بودهایم.[۱۴] در تکنیکی به نام ROSS از ماتریکس بدون سلول دریچه استفاده میشود و به تدریج سلولهای محلی به آن مهاجرت کرده و دریچه، دارای کارایی سابق میگردد. همچنین آلوگرافتهای بدون سلول نقش مهمی را در بازسازی و ترمیم استخوانهای معیوب ایفا میکنند.
محدودیتهای مهندسی بافت میوکارد قلبی از آنجا ناشی میشود که باید خونرسانی و پیوند به بدن بیمار با سرعت انجام شود. با اینکه داربست ماتریکس برونیاختهای، پروتئینها و فاکتورهای رشد بافت اصلی را در خود دارد اما کنترل اختصاصیت بافت قلبی در مرحلهٔ مولکولی میسر نشدهاست. تحقیقات مربوط به ریه، در خصوص سلولزدایی کل اندام و استفاده از آن به عنوان داربست با موفقیت بیشتری همراه بودهاست. محققین توانستهاند کل شُش موش صحرایی را با روش پرفیوژن، سلولزدایی کنند. سپس سلولهای بنیادی جنینی همان موش را وارد اندام فاقد سلول کردند. شُش ساخته شده در آزمایشگاه، با پیوند به بدن موش، شروع به فعالیت کرد.
موفقیتهای دیگر در این زمینه در خصوص بافت زیرمخاطی رودهٔ کوچک، کلیه، کبد[۱۵] و پانکراس[۱۶] است. بافت زیرمخاطی رودهٔ کوچک ضخامت کمی داشته و از طریق تکنیک غوطهورسازی در محلولهای شیمیایی سلولزدایی میشود. تحقیقات دربارهٔ بافت کلیوی همچنان در حال انجام بوده اما نتایج خوبی مشاهده شدهاست. مهندسی بافت پانکراس ثابت کرده که هر بافتی در سطح مولکولی اختصاصیت دارد. تا الان دانشمندان نتوانستهاند کل اندام پانکراس را در آزمایشگاه بسازند اما در تولید اندامی که در بخشهایی کارایی دارد موفق بودهاند. برای مثال، موشهای دیابتی در نقاط خاصی از پانکراسشان ماتریکس بدون سلول را دریافت کرده و بهبود علائم داشتند.[۶]
سلولزدایی امروزه منبع امیدی برای پزشکی بازساختی تلقی شده و کابردهای زیادی از ماتریکسهای بدون سلول در حال کشف شدن است.
پانویس ویرایش
- ↑ Loscalzo, Joseph; Barabasi, Albert-Laszlo (2011-02-24). "Systems biology and the future of medicine". Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 3 (6): 619–627. doi:10.1002/wsbm.144. ISSN 1939-5094.
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ ۲٫۳ Gilbert, Thomas W.; Sellaro, Tiffany L.; Badylak, Stephen F. (2006-07-01). "Decellularization of tissues and organs". Biomaterials. 27 (19): 3675–3683. doi:10.1016/j.biomaterials.2006.02.014. ISSN 0142-9612.
- ↑ Suzuki, Hiroaki R.; Reiter, Rebecca S.; D'Alessio, Marina; Di Liberto, Maurizio; Ramirez, Francesco; Exposito, Jean-Yves; Gambino, Roberto; Solursh, Michael (1997-06-15). "Comparative Analysis of Fibrillar and Basement Membrane Collagen Expression in Embryos of the Sea Urchin, Strongylocentrotus purpuratus". Zoological Science. 14 (3): 449–454. doi:10.2108/zsj.14.449. ISSN 0289-0003.
- ↑ Constantinou, Constantinos D.; Jimenez, Sergio A. (1991-02-01). "Structure of cDNAs Encoding the Triple-Helical Domain of Murine α2 (VI) Collagen Chain and Comparison to Human and Chick Homologues. Use of Polymerase Chain Reaction and Partially Degenerate Oligonucleotides for Generation of Novel cDNA Clones". Matrix. 11 (1): 1–9. doi:10.1016/S0934-8832(11)80221-0. ISSN 0934-8832.
- ↑ ۵٫۰ ۵٫۱ ۵٫۲ ۵٫۳ Crapo, Peter M.; Gilbert, Thomas W.; Badylak, Stephen F. (2011-04-01). "An overview of tissue and whole organ decellularization processes". Biomaterials. 32 (12): 3233–3243. doi:10.1016/j.biomaterials.2011.01.057. ISSN 0142-9612. PMC 3084613. PMID 21296410.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ ۶٫۰ ۶٫۱ ۶٫۲ Ott, Harald C.; Song, Jeremy J. (2011-08-01). "Organ engineering based on decellularized matrix scaffolds". Trends in Molecular Medicine (به انگلیسی). 17 (8): 424–432. doi:10.1016/j.molmed.2011.03.005. ISSN 1471-4914.
- ↑ Taylor, Doris A.; Netoff, Theoden I.; Kren, Stefan M.; Black, Lauren D.; Goh, Saik-Kia; Matthiesen, Thomas S.; Ott, Harald C. (2008-02-12). "Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart". Nature Medicine (به انگلیسی). 14 (2): 213–221. doi:10.1038/nm1684. ISSN 1546-170X.
- ↑ Ott, Harald C.; Ren, Xi; Luis F. Tapias; Charest, Jonathan M.; Gilpin, Sarah E.; Guyette, Jacques P. (2014-06-11). "Perfusion decellularization of whole organs". Nature Protocols (به انگلیسی). 9 (6): 1451–1468. doi:10.1038/nprot.2014.097. ISSN 1750-2799.
- ↑ Flynn, L. E. (2010). "The use of decellularized adipose tissue to provide an inductive microenvironment for the adipogenic differentiation of human adipose-derived stem cells". Biomaterials. 31 (17): 4715–4724. doi:10.1016/j.biomaterials.2010.02.046. ISSN 1878-5905. PMID 20304481.
- ↑ Ott, Harald C.; Matthiesen, Thomas S.; Goh, Saik-Kia; Black, Lauren D.; Kren, Stefan M.; Netoff, Theoden I.; Taylor, Doris A. (2008). "Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart". Nature Medicine. 14 (2): 213–221. doi:10.1038/nm1684. ISSN 1546-170X. PMID 18193059.
- ↑ Guyette, Jacques P.; Gilpin, Sarah E.; Charest, Jonathan M.; Tapias, Luis F.; Ren, Xi; Ott, Harald C. (2014). "Perfusion decellularization of whole organs". Nature Protocols. 9 (6): 1451–1468. doi:10.1038/nprot.2014.097. ISSN 1750-2799. PMID 24874812.
- ↑ Gilpin, Sarah Elizabeth; Guyette, Jacques P.; Gonzalez, Gabriel; Ren, Xi; Asara, John M.; Mathisen, Douglas J.; Vacanti, Joseph P.; Ott, Harald C. (2014). "Perfusion decellularization of human and porcine lungs: bringing the matrix to clinical scale". The Journal of Heart and Lung Transplantation: The Official Publication of the International Society for Heart Transplantation. 33 (3): 298–308. doi:10.1016/j.healun.2013.10.030. ISSN 1557-3117. PMID 24365767.
- ↑ Niklason, Laura E.; Herzog, Erica; Breuer, Christopher; Zhuang, Zhen W.; Yi, Tai; Gavrilov, Kseniya; Raredon, MichaSam B.; Gui, Liqiong; Lee, Eun Jung (2010-07-30). "Tissue-Engineered Lungs for in Vivo Implantation". Science (به انگلیسی). 329 (5991): 538–541. doi:10.1126/science.1189345. ISSN 0036-8075. PMC 3640463. PMID 20576850.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Eschenhagen, Thomas; Ehmke, Heimo; Schwoerer, Alexander; Dhein, Stefan; Michaelis, Bjela; Brune, Kay; Lubos Budinsky; Hess, Andreas; Nixdorff, Uwe (2006-04-12). "Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts". Nature Medicine (به انگلیسی). 12 (4): 452–458. doi:10.1038/nm1394. ISSN 1546-170X.
- ↑ Pinzani, Massimo; Malago, Massimo; Coppi, Paolo De; Dhar, Dipok; Moore, Kevin; Davidson, Brian; Fuller, Barry; Dhillon, Amar P.; Maghsoudlou, Panagiotis (2015-08-07). "Decellularized human liver as a natural 3D-scaffold for liver bioengineering and transplantation". Scientific Reports (به انگلیسی). 5: 13079. doi:10.1038/srep13079. ISSN 2045-2322. PMC 4528226. PMID 26248878.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Goh, Saik-Kia; Bertera, Suzanne; Olsen, Phillip; Candiello, Joseph E.; Halfter, Willi; Uechi, Guy; Balasubramani, Manimalha; Johnson, Scott A.; Sicari, Brian M. (2013-09-01). "Perfusion-decellularized pancreas as a natural 3D scaffold for pancreatic tissue and whole organ engineering". Biomaterials. 34 (28): 6760–6772. doi:10.1016/j.biomaterials.2013.05.066. ISSN 0142-9612. PMC 3748589. PMID 23787110.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link)
منابع ویرایش
| در ویکیانبار پروندههایی دربارهٔ سلولزدایی موجود است. |
- واژههای مصوب فرهنگستان زبان و ادب فارسی
- پایگاه اطلاعرسانی سلولهای بنیادی ایران