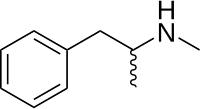
متآمفتامین
متآمفتامین[یاد ۱] یک محرک قوی دستگاه عصبی مرکزی (سیاناس) است که عمدتاً به عنوان یک داروی تفریحی یا افزایشدهنده عملکرد مورد استفاده قرار میگیرد و کمتر به عنوان یک درمان خط دوم برای اختلال کمتوجهی-بیشفعالی (ایدیاچدی) و چاقی استفاده میشود.[۱] همچنین تحقیقاتی در مورد استفاده از آن به عنوان یک درمان ممکن برای ضربه مغزی انجام شده است.[۲] متآمفتامین در سال ۱۸۹۳ کشف شد و به دو انانتیومر: لوومتآمفتامین و دکسترو متآمفتامین وجود دارد. متآمفتامین به طور خاص به یک ماده شیمیایی خاص اشاره دارد، که به شکل آزاد راسمیک است، که مخلوطی برابر از لوومتآمفتامین و دکسترو متآمفتامین در فرمهای آمین خالص خود است، اما نمک هیدروکلرید، که به طور معمول به آن کریستال مت میگویند، به طور گستردهای استفاده میشود. متآمفتامین به ندرت تجویز میشود به دلیل نگرانیهایی پیرامون پتانسیل آن برای استفاده تفریحی به عنوان یک هوسافزا و سرخوشی، و همچنین در دسترس بودن داروهای جایگزین با ایمنی بیشتر و کارایی درمانی قابل مقایسه مانند آدرال و ویوانس.[۳] دکسترو متآمفتامین یک محرک دستگاه عصبی مرکزی قویتر از لوومتآمفتامین است.
 | |
| دادههای بالینی | |
|---|---|
| نامهای دیگر | Desoxyephedrine Methamphetamine Pervitin Anadrex Methedrine Methylamphetamine Syndrox Desoxyn |
| روش مصرف دارو | Medical: Ingestion Recreational: Ingestion, Intravenous, Insufflation, Inhalation, Suppository |
| کد ATC | |
| وضعیت قانونی | |
| وضعیت قانونی |
|
| دادههای فارماکوکینتیک | |
| زیست فراهمی | 62.7% oral; 79% nasal; 90.3% smoked; 99% rectally; 100% IV |
| متابولیسم | کبد |
| نیمهعمر حذف | ۹–۱۲ ساعت |
| دفع | کلیه |
| شناسهها | |
| |
| شمارهٔ سیایاس | |
| پابکم CID | |
| دراگبنک | |
| کماسپایدر | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.007.882 |
| دادههای فیزیکی و شیمیایی | |
| فرمول شیمیایی | C۱۰H۱۵N۱ |
| جرم مولی | ۱۴۹/۲۳۳ g·mol−1 |
| مدل سه بعدی (جیمول) | |
| |
| |
| | |
هر دو متآمفتامین راسمیک و دکسترو متآمفتامین به دلیل پتانسیل استفاده تفریحی به طور غیرقانونی قاچاق و فروخته میشوند. بالاترین شیوع استفاده غیرقانونی از متآمفتامین در بخشهایی از آسیا و اقیانوسیه و همچنین در ایالات متحده مشاهده میشود، جایی که متآمفتامین راسمیک و دکسترو متآمفتامین به عنوان مواد کنترلشده رده دو طبقهبندی شدهاند. لوومتآمفتامین به عنوان یک داروی بدون نسخه برای استفاده به عنوان یک ضد احتقان بینی استنشاقی در ایالات متحده در دسترس است. در سطح بینالمللی، تولید، توزیع، فروش و داشتن متآمفتامین در بسیاری از کشورها محدود یا ممنوع شده است، به دلیل قرار داشتن آن در رده دو پیمان کنوانسیون سازمان ملل در مورد مواد روانگردان. در حالی که دکسترو متآمفتامین داروی قویتری است، متآمفتامین راسمیک اغلب به طور غیرقانونی تولید میشود، به دلیل سهولت نسبی در سنتز و محدودیتهای قانونی در دسترسی به پیشمادههای شیمیایی.
در دوزهای پایین تا متوسط، متآمفتامین میتواند حالت روحی را افزایش دهد، هشیاری، تمرکز و انرژی را در افراد خسته افزایش دهد، اشتها را کاهش دهد و به کاهش وزن کمک کند. در دوزهای بسیار بالا، میتواند منجر به روانپریشی، تخریب عضلات اسکلتی، تشنج و خونریزی در مغز شود. استفاده مزمن از دوزهای بالا میتواند نوسانات خلقی غیرقابل پیشبینی و سریع، روانپریشی ناشی از محرک (مانند پارانویا، توهمات، دلیریوم و هذیان) و رفتارهای خشونتآمیز ایجاد کند. به صورت تفریحی، توانایی متآمفتامین در افزایش انرژی گزارش شده است که میتواند حالت روحی را تقویت کند و میل جنسی را تا جایی افزایش دهد که مصرفکنندگان قادر به انجام فعالیت جنسی بهطور مداوم برای چندین روز در حین مصرف این دارو باشند.[۴] متآمفتامین به داشتن احتمال بالای اعتیاد (به معنای بالا بودن احتمال اینکه استفاده طولانیمدت یا دوزهای بالا منجر به استفاده اجباری از دارو شود) و وابستگی (به معنای بالا بودن احتمال بروز علائم ترک در زمانی که مصرف متآمفتامین متوقف میشود) شناخته شده است. قطع مصرف متآمفتامین پس از استفاده سنگین ممکن است منجر به یک سندرم حاد پس از ترک شود که ممکن است برای ماهها بعد از دوره معمولی ترک ادامه یابد. در دوزهای بالا، متآمفتامین برای نورونهای دوپامینرژیک در میانمغز انسان سمی است و بهطور کمتر برای نورونهای سروتونرژیک نیز ممکن است سمی باشد.[۵][۶] سمی بودن متآمفتامین باعث تغییرات نامطلوب در ساختار و عملکرد مغز میشود، مانند کاهش حجم ماده خاکستری در چندین ناحیه مغز و همچنین تغییرات نامطلوب در نشانگرهای تمامیت متابولیک.[۷]
متآمفتامین به طبقهبندی شیمیایی فنیلاتیلآمینهای جانشینی شده و آمفتامینهای استخلافی شده تعلق دارد. این ماده به دیگر دیمتیلفنیلاتیلآمینها به عنوان ایزومر ساختاری این ترکیبات مرتبط است، که فرمول شیمیایی مشترک C
10H
15N را دارند.
موارد مصرف
ویرایشاصلیترین کاربرد دارویی ترکیبات آمفتامین اختلال کمتوجهی - بیشفعالی است، هرچند گاهی در درمان نارکولپسی (حملات خواب) و چاقیهای مقاوم به درمان نیز استفاده میشوند.[۸][۹]
تاریخچه
ویرایشاین ماده در سال ۱۸۹۳ در ژاپن ساخته شد. در زمان جنگ جهانی دوم توسط سربازان ژاپنی، آمریکایی برای برطرف کردن خستگی و افزایش انرژی استفاده میشد. (در این مورد ابهاماتی وجود دارد) بعد از جنگ داروی باقیمانده وارد بازار سیاه ژاپن شد و یک همهگیری از مصرف متآمفتامین رخ داد و باعث شد که مصرف آن ممنوع شود.
در ایران قبل از دهه ۱۳۷۰ مصرف شیشه بسیار محدود بود و در مطالعه بررسی سریع وضعیت سوءمصرف مواد در ایران که در سال ۱۳۸۳ انجام شد، هیچ موردی از مصرف پیدا نشد. البته میتوان حدس زد که تعداد محدودی مصرفکننده وجود داشتهاست. همان مطالعه در سال ۱۳۸۶ تکرار شد و اینبار سه و نیم درصد مصرفکننده شیشه گزارش شد. اوج مصرف شیشه از سال ۱۳۸۷ و همزمان با تولید داخلی آن در بازار سیاه آغاز شد. از آن هنگام تا دی ماه ۱۳۸۷ قیمت این ماده به شدت کاهش یافته و از گرمی ۱۲۰۰۰۰ تومان به ۲۵۰۰۰ تومان در سال ۱۳۸۸ و به حدود ۸۰۰۰ تومان در پاییز ۱۳۸۹ کاهش یافتهاست. به همین نسبت میزان مصرفکنندگان به شدت افزایش یافته و تخمین متخصصان بر این بود که در سال ۱۳۸۹ از نظر تعداد مصرفکننده به دومین ماده شایع تبدیل شدهاست و تعداد مصرفکنندگان آن هر روزه افزایش میباید.
در سال ۱۳۹۱ و همزمان با افزایش ناگهانی قیمت دلار در ایران، قیمت مواد مخدر از جمله شیشه هم به مقدار قابل توجهی تا چند برابر افزایش یافت. همچنین به نظر میرسد که در سالهای اخیر فراوانی مصرف سیر افزایشی دارد و پیشبینی میشود که این روند احتمال افزایش داشته باشد. همچنین پیمایش ملی سلامت روان که در سال ۱۳۸۹ و ۱۳۹۰ روی ۷۸۸۶ نفر در کشور انجام شد نشان داد که همچنان تریاک و مواد افیونی پرمصرفترین مواد در کشور هستند و مواد محرک پس از مواد افیونی، الکل و حشیش در رتبه چهارم مواد پرمصرف قرار دارد.
تأثیرات
ویرایشغالباً «مِتآمفتامین» عوارض فاجعه بار و جبرانناپذیری بر روی افراد نرمال دارد که با ورود به سیستم عصبی مرکزی باعث آزاد شدن ناگهانی انتقال دهنده عصبی دوپامین در مغز میشود که باعث تحریک سلولهای مغزی و افزایش حالت تهاجمی و افزایش حرکات جسمی میشود. بعد از پایان یافتن اثرات این ماده، علایم بدخلقی و افسردگی و علایم اختلال حرکتی مثل پارکینسون در فرد نرمال ظاهر میشود. همچنین این ماده در همان ابتدای مصرف صدمات جبرانناپذیری را به مغز وارد میآورد که افت حافظه، پرخاشگری و تهاجم، رفتارهای جنون آمیز و آسیبهای قلبی و مغزی از عوارض مصرف آن در اشخاص بدون اختلال در تمرکز است. این ماده به صورت داخل بینی و خوراکی و تزریق وریدی و کشیدنی یا تدخین مصرف میشود و بلافاصله بعد از مصرف حالتی به نام rush یا flash به فرد دست میدهد. با مصرف این ماده حالاتی مثل هیجان زدگی، بی تابی، سخنگفتن تند، کاهش خواب و کاهش اشتها و افزایش فعالیتهای فیزیکی به وجود میآید.
مصرف این ماده میتواند باعث کاهش اشتها برای روزها، افزایش تعداد تنفس، افزایش فعالیت فیزیکی، افزایش دمای بدن و تحریکپذیری و بی خوابی گیجی، لرزش و تشنج، اضطراب و بدبینی (پارانوئید) و خشونت را سبب شود؛ که تشنج و افزایش زیاد دمای بدن میتواند باعث مرگ شود. همچنین با انقباض عروق امکان بروز سکته مغزی و سکته قلبی بالا میرود.
یکی از عوارض روانی آن ایجاد بیماری روانی شبیه اسکیزوفرنی است شامل توهمات بینایی و شنوایی و بدبینی و پرخاشگری است. احساس کرم زدگی توهمی هست که میان مصرفکنندگان آمفتامینها رایج است و علت آن اثر محرک شیشه روی مغز میباشد. توهم کرم زدگی و وجود کرمهایی که تمام بدن و صورت را میخورند تا آنجا شدید است که میتواند باعث شود شخص در حالت توهم ناشی از شیشه به خودش آسیب شدیدی وارد کند که گاهی هم به بستری شدن فرد میانجامد. همراه بودن مصرف شیشه با عفونتهای پوستی و پوسیدگی شدید دندانها باعث شدهاست شایعه کرم زدگی بدن گسترش پیدا کند. دهان عفونی (Meth Mouth) معتادان آمفتامین یکی از شدیدترین عفونتهای دهانی و پوسیدگی دندان است. علت این عفونت اثر (تنگکننده عروق) ماده متآمفتامین و اثرات جانبی آن مثل خشکی دهان، تنبلی و بی خیالی، مصرف زیاد مشروبات و نوشابه برای جبران کمآبی و حل کردن شیشه عوامل اصلی این عفونت دهانی و دندانی هستند.
مصرف آمفتامین یا شیشه با خلوص پائین که مخلوط با مواد دیگری از جمله شکر یا جوش شیرین است عوارض شدیدتری نسبت به آمفتامین خالص دارد. پارگی رگها، گرفتگی عضلانی و عفونت پوستی یا داخلی از این عوارض بهحساب میآید. ضمناً موارد مرگ در اثر مصرف بیش از حد یا اُوِر دوز در این نوع مواد بیشتر از مواد خالص است چراکه احتمال دارد بدون اطلاع فرد، ماده مخدری که از فروشنده ناشناسی تهیه شده دارای خلوص یا دوز بالاتری نسبت به ماده معمول داشته باشد. تذکر اینکه این تأثیرات بر افراد با عارضه بیش فعالی دیده نشده یا به ندرت گزارش شدهاست،
عوارض طبی
ویرایشاثرات مخرب مصرف متآمفتامین بر سلامت عمومی گسترده بوده و مکانیسمهای زیرین آن شامل تغییرات در سیستمهای فیزیولوژیک چندگانه میشود که برجستهترین آنها سیستم اعصاب خودکار است. به صورت خاص، فعالسازی حاد سیستم اعصاب سمپاتیک میتواند هایپرتانسیون، تاکیکاردی، افزایش تعداد تنفس (برای مثال تاکی پنه)، هیپرترمی محیطی، گشادی مردمکها، افزایش تعریق (دیافورزیس) و انقباض عروق خونی (وازوکانستریکشن) ایجاد کند. برعکس این، اثرات تقویتکننده مثبت روان شناختی و فیزیولوژیک مصرف متآمفتامین شامل سرخوشی شدید، افزایش انرژی و هوشیاری و احساس ظرفیت جسمی و روانی افزایش یافته و در ابتدا باعث کاهش اضطراب و افزایش لیبیدو میشود. با مصرف طولانی مدت این ماده کمبودهای تغذیهای میتواند رخ دهد. با کاهش اثرات تقویتکنندگی مثبت متآمفتامین متعاقب مصرف مکرر، اثرات سمی حاصله میتواند در ایجاد اضطراب تشدید شده و تحریکپذیری، خود را نشان دهد. مصرف طولانی مدت متآمفتامین همچنین با میزانهای افزایش شدت بیماریهای عفونی شامل اچ آی وی، هپاتیت ب و سی و اندوکاردیت یا عفونت لایه داخلی عضله قلب و دریچهها همراه است.
عوارض مسمومیت دستگاه اعصاب مرکزی شامل دامنه وسیعی از تغییرات حالت روانی، سمیت عصبی، سکته مغزی و سایر آسیبهای بافت مغز میشود.
متآمفتامین با سمیت قلبی و پاتولوژی بافت قلب خصوصاً در صورت مصرف طولانی مدت همراه است. به خاطر خواص سمپاتومیمتیک ناشی از افزایش فعالیت کاتکولآمینها، بالا رفتن ضربان قلب و فشار خون. درد قفسه سینه، کم شدن تنفس و سندرم حاد کرونری شایعترین تظاهرات اولیه مصرف متآمفتامین هستند. کاهش جبرانی ضربان قلب نیز میتواند رخ دهد.
شواهد اخیر نشان میدهند مصرف متآمفتامین با مجموعهای از مشکلات سلامت دهانی مرتبط است. اصطلاح «دهان مت» برای اشاره به اثرات مخرب متآمفتامین بر سلامت دندانها استفاده میشود. شایعترین مشکلات سلامت دهانی گزارش شده در مصرفکنندگان متآمفتامین شامل پوسیدگی فراگیر دندانها و شکستگی آنها و بیماریهای پریودنتال (برای مثال ژنژویت و پریودوندیت) است و بحث قابل ملاحظهای دربارهٔ سببشناسی این مشکلات و پیامدهای بالینی آن ادامه دارد.
تظاهرات پوستی سوءمصرف متآمفتامین اغلب نتیجه آسیب به خود هنگام مسمومیت، عفونت ناشی از تزریق مکرر، یا سوختگیهای تصادفی مرتبط با فرایند تولید دارو هستند. هنگام تجربه علایم جسمی یا روانپزشکی ناراحتکننده، مصرفکنندگان متآمفتامین ممکن است خارش مکرر پوستی داشته باشند که باعث ایجاد خراشیدگی یا زخمهای پوستی میشود. این رفتارها نوعاً در نتیجه اختلالات ادراکی القاءشده توسط مواد مثل فورمیکیشن ایجاد میشوند که نوعی احساس خزش حشرات رو یا زیر سطح پوست است.[۱۰]البته نباید این نکته را با وجود لایههای قارچی مخصوصاً قارچ پوستی کاندیدا که بر روی پوست اکثریت جوامع انسانی دیده میشود و به واقع عفونتهای قارچی ایجاد میکند، اشتباه گرفت و مبارزه با آن در افراد را اختلالات ادراکی دانست. همچنین باید به این مطلب که تأثیرات این ماده بر افراد با عارضه بیش فعالی با تاثیراتش بر افراد عادی هرگز یکسان نبوده و متفاوت است، اشاره شود.
عوارض عصبی شناختی
ویرایشاگرچه مصرف اولیه متآمفتامین به دلایل متفاوت اجتماعی–فرهنگی و روانی است؛ اما زمانی که برای اولین بار این ماده وارد بدن شود تغییرات عمیقی در ساختار شیمیایی مغز ایجاد میکند. متآمفتامین با جذب دوپامین آزاد شده شکاف سیناپسی را مسدود میکند و در نتیجه منجر به افزایش سطح دوپامین در سیناپس عصبها، در هستههای اکامبنز و دیگر بخشهای مزولیمبیک مغز میگردد. «مصرف طولانی مدت و مزمن متآمفتامین منجر به پایین آمدن سطح گیرندههای دوپامین شده و در نتیجه افزایش وابستگی به این ماده، یعنی از دست دادن کنترل و مصرف اجباری متآمفتامین را در پی دارد. هم چنین، مصرف متآمفتامین منجر به از دست دادن انتقال دهندههای دوپامین میگردد (به عنوان نشانگر پایانه دوپامین) که با کم شدن سرعت عملکرد و افت حافظه و تمرکز و عملکردهای شناختی مانند کنترل مهاری همراه هستند. علاوه بر این، متآمفتامین غلظت سیتوپلاسمیک دوپامین را افزایش داده؛ که تولید اکسیداسیون را رونق داده، که برای پایانههای عصبی سمی هستند.»[۱۱][۱۲]
«بر اساس تخمینهای اخیر ۴۰ درصد مصرفکنندگان متآمفتامین با مصرف در حد وابستگی علایمی از نقایص عصبی روانشناختی کلی را نشان میدهند. اثرات متآمفتامین بر کارکرد عصب روانشناختی میتواند بر اساس کمیت مصرف، دفعات مصرف و شدت وابستگی متفاوت باشد، گرچه در برخی مطالعات شواهد مبنی بر چنین ارتباطی تأیید نشد. دوزهای منفرد به صورت جالب توجهی با تقویت عملکرد در حوزههای عصبی روانشناختی مختلف در آزمودنیهای انسانی طبیعی مرتبط است. برعکس این، بر اساس یک فراتحلیل اخیر در خصوص اثرات سوءمصرف و وابستگی به متآمفتامین، مصرف مزمن آن با نقایص در حوزههای متعدد شامل نقایص با شدت متوسط در فرایند درگیرسازی مدارهای فرونتواستریاتال و لیمبیک همچون حافظه دورهای، کارکردهای اجرایی و تکالیف سایکوموتور میشود. تا حد کمتری، مصرف متآمفتامین با اثرات منفی بر توجه، حافظه کارکردی، زبان و کارکردهای دیداری همراه است. شدت نقایص عصبی، شناختی میتواند درطول دوره اولیه پرهیز در مقایسه با مصرفکنندگان فعال بدتر شود و میتواند برای ۹ ماه یا بیشتر متعاقب پرهیز اولیه ادامه پیدا کند، گرچه، تداوم پرهیز با بهبودی در کارکرد پایانه دوپامین و حداقل بهبودی نسبی در کارکردشناختی در افراد وابسته به متآمفتامین همراه است. مصرفکنندگان متآمفتامین ممکن است حرکات هیپرکینتیک شامل رفتارهای تکراری و کلیشهای نشان دهند. این اثرات حتی به صورت گستردهای در مطالعات حیوانی نشان داده شدهاست. اختلالات حرکات کره آتتویئد نیز مشاهده شدهاست. به علاوه، گرچه پیشنهاد شدهاست که نقایص دوپامینرژیک مصرف متآمفتامین میتواند علایم پارکینسون ایجاد کند اما شواهد پژوهش بالینی در حمایت از این نظریه محدود باقی ماندهاست. نشان داده شده که مصرف مزمن متآمفتامین باعث سمیت عصبی به صورت کاهش فعالیت انتقال دهنده دوپامین استریاتال شده و این میتواند به لحاظ بالینی با نقایص شناختی و کندی سایکوموتور همراهی داشته باشد.»[۱۳][۱۴]
«عملکرد حافظه آینده نگر برای مصرفکنندگان سابق متآمفتامین حتی کسانی که در حال ترک هستند حساس است. سابقهٔ مصرفکنندگان متآمفتامین، اختلالاتی را با حافظه آینده نگر ایجاد میکند، و نشان میدهد که این اختلالات به احتمال زیاد پیامدهای مهمی برای عملکرد روزانه در پی دارند.»[۱۵] «مشابه مصرف دیگر محرکها توسط افراد، وابستگان متآمفتامین دارای تصمیمگیریهای مخاطرهآمیز و تکانشگری میباشند که از طریق حساسیت به پاداشهای فوری در مقابل پاداشهای تأخیری، در انتخاب گزینههای نامطلوب یا انتخابهای تکانشگری در مقایسه با افراد نرمال و از الگوهای رفتاری تکانشگری ارزیابی میشوند. اختلال در تصمیمگیری و حافظهٔ فعال ممکن است مصرفکنندگان متآمفتامین را به انجام رفتارهای مخاطره آمیز در «دنیای واقعی» مانند استفاده از سرم مشترک یا رابطه جنسی حفاظت نشده، سوق دهد که باعث افزایش خطر انتقال HIV و HCV به همراه نتایج پزشکی، عصبی روان شناختی و روانی- اجتماعی ضعیف تر میشود.»[۱۳]
شرح بالینی بیماران وابسته به متآمفتامین، اغلب بیتوجهیهای ظاهری و حواسپرتی این بیماران را برجسته میکند. نشان داده شدهاست که افراد وابسته به متآمفتامین در دقت و توجه در نمونههای آزمایشگاهی دچار اختلال هستند. توانایی توجهای پایدار نیز ممکن است در مصرفکنندگان متآمفتامین مستعد اختلال باشد، که شاید مرتبط با آسیبهای عصبی در قشر سینگولیت قدامی و قشر منزوی قدامی باشد. اختلال محدود در زبان، مشاهده شده در مصرفکنندگان متآمفتامین؛ ممکن است تا حدی با سرعت پردازش اطلاعات و اختلال اجرایی توضیح داده شده در بالا مرتبط باشد.»[۱۳] جالب اینکه موارد فوقالذکر در افراد بیش فعال در هنگام مصرف وجود ندارد و عدم مصرف این ماده باعث اختلالات متعدد در این افراد میشود.
تبعات اجتماعی
ویرایششیوع مصرف غیرقانونی متآمفتامین در ۱۰ سال اخیر رو به افزایش بودهاست و در حال حاضر به میزبانی برای عوارض جانبی روانی-اجتماعی (به عنوان مثال، بیکاری)، بیماری روانی (به عنوان مثال، افسردگی)، و بیماریهای بدنی (به عنوان مثال، قلب و عروق) تبدیل شدهاست. هم چنین متآمفتامین دارای اثرات سمیت عصبی (نوروتوکسیک) است و مصرف مزمن ان با اثرات مضر بر روی انتقال دهندههای عصبی (به عنوان مثال، تخلیه دوپامین و یکپارچگی عملکردی و ساختاری عصبی مدارهای قدامی-مخطط و لیمبیک همراه است. علاوه بر این وابستگی به متآمفتامین با اختلال عصبی روان شناختی در ارتباط است. برآورد اندازه اثر در مطالعات تفاوت متوسطی را در حوزههای مختلف عملکردی نشان دادهاند که بزرگترین اختلالات در حافظه اپیزودیک، عملکردهای اجرایی، سرعت پردازش اطلاعات و اختلالات کمی کوچکتر در مهارتهای حرکتی، زبان و توانایی visuoconstruction همراه است. اگر زیاد مصرف شود باعث ناباروری در مردان میشود.
تحقیقات
ویرایشبر طبق تحقیقاتی که روی حیوانات انجام شده، مشخص شده کلسیتریول که فرم فعال ویتامین دی میباشد میتواند اثرات محافظت کنندهای در مقابل دوزهای نوروتوکسیک متامفتامین داشته باشد.[۱۶]
جستارهای وابسته
ویرایشیادداشت
ویرایش- ↑ در بازار سیاه آمریکا با نام مِث (Meth) و در ایران با نام شیشه (Crystal) شناخته میشود.[نیازمند منبع]
پانویس
ویرایش- ↑ Moszczynska A, Callan SP (September 2017). "Molecular, Behavioral, and Physiological Consequences of Methamphetamine Neurotoxicity: Implications for Treatment". The Journal of Pharmacology and Experimental Therapeutics. 362 (3): 474–488. doi:10.1124/jpet.116.238501. PMC 11047030. PMID 28630283.
METH is a schedule II drug, which can only be prescribed for attention deficit hyperactivity disorder (ADHD), extreme obesity, or narcolepsy (as Desoxyn; Recordati Rare Diseases LLC, Lebanon, NJ), with amphetamine being prescribed more often for these conditions due to amphetamine having lower reinforcing potential than METH (Lile et al., 2013).
- ↑ Rau, Thomas; Ziemniak, John; Poulsen, David (2016-01-04). "The neuroprotective potential of low-dose methamphetamine in preclinical models of stroke and traumatic brain injury". Progress in Neuro-Psychopharmacology and Biological Psychiatry. 64: 231–236. doi:10.1016/j.pnpbp.2015.02.013. ISSN 0278-5846.
- ↑ Moszczynska A, Callan SP (September 2017). "Molecular, Behavioral, and Physiological Consequences of Methamphetamine Neurotoxicity: Implications for Treatment". The Journal of Pharmacology and Experimental Therapeutics. 362 (3): 474–488. doi:10.1124/jpet.116.238501. PMC 11047030. PMID 28630283.
METH is a schedule II drug, which can only be prescribed for attention deficit hyperactivity disorder (ADHD), extreme obesity, or narcolepsy (as Desoxyn; Recordati Rare Diseases LLC, Lebanon, NJ), with amphetamine being prescribed more often for these conditions due to amphetamine having lower reinforcing potential than METH (Lile et al., 2013).
- ↑ «Meth's aphrodisiac effect adds to drug's allure - Health - Addictions | NBC News». web.archive.org. ۲۰۱۳-۰۸-۱۲. دریافتشده در ۲۰۲۴-۱۰-۲۵.
- ↑ Yu S, Zhu L, Shen Q, Bai X, Di X (March 2015). "Recent advances in methamphetamine neurotoxicity mechanisms and its molecular pathophysiology". Behavioural Neurology. 2015 (103969): 1–11. doi:10.1155/2015/103969. PMC 4377385. PMID 25861156.
- ↑ Krasnova IN, Cadet JL (May 2009). "Methamphetamine toxicity and messengers of death". Brain Res. Rev. 60 (2): 379–407. doi:10.1016/j.brainresrev.2009.03.002. PMC 2731235. PMID 19328213.
Neuroimaging studies have revealed that METH can indeed cause neurodegenerative changes in the brains of human addicts (Aron and Paulus, 2007; Chang et al., 2007). These abnormalities include persistent decreases in the levels of dopamine transporters (DAT) in the orbitofrontal cortex, dorsolateral prefrontal cortex, and the caudate-putamen (McCann et al., 1998, 2008; Sekine et al., 2003; Volkow et al., 2001a, 2001c). The density of serotonin transporters (5-HTT) is also decreased in the midbrain, caudate, putamen, hypothalamus, thalamus, the orbitofrontal, temporal, and cingulate cortices of METH-dependent individuals (Sekine et al., 2006) ...
Neuropsychological studies have detected deficits in attention, working memory, and decision-making in chronic METH addicts ...
There is compelling evidence that the negative neuropsychiatric consequences of METH abuse are due, at least in part, to drug-induced neuropathological changes in the brains of these METH-exposed individuals ...
Structural magnetic resonance imaging (MRI) studies in METH addicts have revealed substantial morphological changes in their brains. These include loss of gray matter in the cingulate, limbic and paralimbic cortices, significant shrinkage of hippocampi, and hypertrophy of white matter (Thompson et al., 2004). In addition, the brains of METH abusers show evidence of hyperintensities in white matter (Bae et al., 2006; Ernst et al., 2000), decreases in the neuronal marker, N-acetylaspartate (Ernst et al., 2000; Sung et al., 2007), reductions in a marker of metabolic integrity, creatine (Sekine et al., 2002) and increases in a marker of glial activation, myoinositol (Chang et al., 2002; Ernst et al., 2000; Sung et al., 2007; Yen et al., 1994). Elevated choline levels, which are indicative of increased cellular membrane synthesis and turnover are also evident in the frontal gray matter of METH abusers (Ernst et al., 2000; Salo et al., 2007; Taylor et al., 2007). - ↑ Krasnova IN, Cadet JL (May 2009). "Methamphetamine toxicity and messengers of death". Brain Res. Rev. 60 (2): 379–407. doi:10.1016/j.brainresrev.2009.03.002. PMC 2731235. PMID 19328213.
Neuroimaging studies have revealed that METH can indeed cause neurodegenerative changes in the brains of human addicts (Aron and Paulus, 2007; Chang et al., 2007). These abnormalities include persistent decreases in the levels of dopamine transporters (DAT) in the orbitofrontal cortex, dorsolateral prefrontal cortex, and the caudate-putamen (McCann et al., 1998, 2008; Sekine et al., 2003; Volkow et al., 2001a, 2001c). The density of serotonin transporters (5-HTT) is also decreased in the midbrain, caudate, putamen, hypothalamus, thalamus, the orbitofrontal, temporal, and cingulate cortices of METH-dependent individuals (Sekine et al., 2006) ...
Neuropsychological studies have detected deficits in attention, working memory, and decision-making in chronic METH addicts ...
There is compelling evidence that the negative neuropsychiatric consequences of METH abuse are due, at least in part, to drug-induced neuropathological changes in the brains of these METH-exposed individuals ...
Structural magnetic resonance imaging (MRI) studies in METH addicts have revealed substantial morphological changes in their brains. These include loss of gray matter in the cingulate, limbic and paralimbic cortices, significant shrinkage of hippocampi, and hypertrophy of white matter (Thompson et al., 2004). In addition, the brains of METH abusers show evidence of hyperintensities in white matter (Bae et al., 2006; Ernst et al., 2000), decreases in the neuronal marker, N-acetylaspartate (Ernst et al., 2000; Sung et al., 2007), reductions in a marker of metabolic integrity, creatine (Sekine et al., 2002) and increases in a marker of glial activation, myoinositol (Chang et al., 2002; Ernst et al., 2000; Sung et al., 2007; Yen et al., 1994). Elevated choline levels, which are indicative of increased cellular membrane synthesis and turnover are also evident in the frontal gray matter of METH abusers (Ernst et al., 2000; Salo et al., 2007; Taylor et al., 2007). - ↑ "Desoxyn Prescribing Information" (PDF). United States Food and Drug Administration. December 2013. Archived (PDF) from the original on 2 January 2014. Retrieved 6 January 2014
- ↑ Hart CL, Marvin CB, Silver R, Smith EE (February 2012). "Is cognitive functioning impaired in methamphetamine users? A critical review". Neuropsychopharmacology. 37 (3): 586–608. doi:10.1038/npp.2011.276. PMC 3260986. PMID 22089317
- ↑ .Addiction Medicine2011-Science and PracticeBankole A. Johnson, DSc, MD
- ↑ Addiction Medicine2011-Science and PracticeBankole A. Johnson, DSc, MD
- ↑ Methamphetamine Addiction-From Basic Science to Treatment-Edited byJohn M. RollRichard A. RawsonWalter Ling Steven Shoptaw.TRANSLATE BY DR.ALIREZA NOROZI
- ↑ ۱۳٫۰ ۱۳٫۱ ۱۳٫۲ Neurocognitive Effects of Methamphetamine: A Critical Review and Meta analysis-J. Cobb Scott & Steven Paul Woods & Georg E. Matt-Neuropsychol Rev (2007) 17:275–297DOI 10.1007/s11065-007-9031-0
- ↑ The Comparison of Cognitive Functions in Patients withMethamphetamine induced Psychosis and Control GroupAsgharEghtedari,VahidShariat,HojjatollahFarahani,Advances in Cognitive Science Vol. 13, No. 4, 2012
- ↑ Prospective memory impairment in former users of methamphetamine Peter G. Rendell & Magdalena Mazur & Julie D. Henry.Psychopharmacology (2009) 203:609–616DOI 10.1007/s00213-008-1408-0
- ↑ Cass WA, Smith MP, Peters LE (2006). "Calcitriol protects against the dopamine- and serotonin-depleting effects of neurotoxic doses of methamphetamine". Annals of the New York Academy of Sciences. 1074 (1): 261–71. Bibcode:2006NYASA1074..261C. doi:10.1196/annals.1369.023. PMID 17105922.